Характерные химические свойства кислот
1. Кислота + металл = соль + водород (если:
металл находится в ряду напряжений до водорода;
образуется растворимая соль;
кислота растворима).
Примечания. 1) Щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют в первую очередь с водой.
2) Азотная кислота любой концентрации и концентрированная серная кислота взаимодействуют с простыми веществами по-особому.
2. Кислота + оксид металла (основный или амфотерный) = соль + вода.
3. Кислота + основание (гидроксид или бескислородное основание) = соль + вода (для бескислородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок или газ).
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щёлочь = новая соль + новое основание (если образуется осадок или газ).
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок).
4. Соль (раствор) + металл = новая соль + новый металл (если:
металл находится в ряду напряжений слева от металла, образующего соль;
Примеры тестовых заданий и рекомендации к их выполнению
1. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) А1, Zn, Си 3) Mg, Zn, Fe
2) Zn, Fe, Pb 4) Pb, Си, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II)— практически нерастворимая соль, о чём свидетельствует соответствующая клеточка в таблице растворимости. Ответ: 3.
2. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1,2 и 4. Ответ: 3.
3. С раствором хлорида меди (II) не реагирует
1)Мg 2) Zn 3) Fe 4) Ag
Лёгкое задание на знание ряда напряжений металлов. Ответ: 4.
4. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида — щёлочи. Следовательно, это должен быть оксид щелочного или щёлочноземельного металла. Ответ: 3.
5. С гидроксидом бария реагирует каждое из веществ, формулы которых
1) NaCl, Na2SO4, Na2CO3 3) ZnO, K2O, CO22) HNO3, NaOH, K2SO4 4) Al(OH)3, CuSO4, HCl
Так как Ba(OH)2 — щёлочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ — 4. К такому же результату можно прийти, исключив варианты 2 (он включает щёлочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта — соли, но если две последние соли образуют осадок с гидроксидом бария, то первая — нет. Ответ: 4.
6. В цепочке превращений
S → X1 → SO3 → Х2 → CuSO4 → Х3 → CuO → Сu
веществами Х1, Х2 и Х3 являются соответственно
1) H2S, H2SO4, Cu(OH)2 3) SO2, H2SO4, CuCl22) FeS, H2SO4, Cu(OH)2 4) SO2, H2SO4, Cu(OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, a SO2. В варианте 3 первые два искомых вещества указаны верно, a CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию невозможно. Ответ: 4.
7. Установите соответствие между веществом, реагирующим с железом (левый столбец), и названием железосодержащего продукта, который при этом образуется (правый столбец).
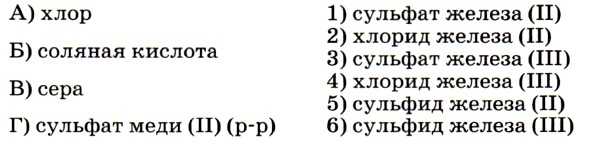
Задание выполнить несложно, так как из числа приведённых в условии реагентов только сильный окислитель — хлор окисляет железо до степени окисления +3 (соответствие А — 4). Остальные реагенты окисляют его до степени окисления +2. Ответ: 4251.
8. Установите соответствие между названием вещества (левый столбец) и названием продукта его горения (правый столбец).

Знание химических свойств простых веществ, указанных в левом столбце, позволит легко установить верные соответствия. Ответ: 635.
9. Установите соответствие между исходными веществами (левый столбец) и продуктами их взаимодействия (правый столбец).
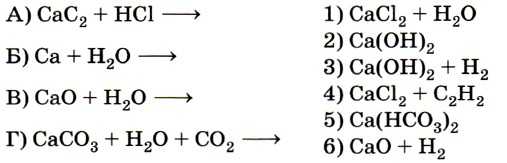
Вначале исключается заведомо неверный вариант 6 (в водной среде образование оксида кальция невозможно). Очевидно, необходимо исключить и вариант 1, так как для него нет соответствующей левой части уравнения. Некоторые сложности может вызвать соответствие Г — 5, основанное на знании перехода карбоната в гидрокарбонат и обратно. Ответ: 4325.
10. Установите соответствие между названием оксида (левый столбец) и формулами веществ, с которыми он взаимодействует (правый столбец).

В соответствии с рекомендациями для задания 1 для оксида хрома (В) исключаются варианты 1, 2, 4, 6 и устанавливается соответствие с 5 (как амфотерный оксид, Сr2O3 взаимодействует с щелочами, а также восстанавливается алюминием). Оксид калия, как основный, взаимодействует с веществами группы 4. Несолеобразующий оксид углерода (II) является восстановителем и вступает в реакции с веществами группы 3: взаимодействием СО с Н2 получают метанол, восстанавливают железо из оксидов (чёрная металлургия) и используют как газообразное топливо (генераторный газ).
Кислотный оксид азота (V) взаимодействует с веществами группы 1. Ответ: 4351.
Химия 9 класс (Габриелян) Контрольная работа № 2
К-2 Вариант 1
Часть 1. Тестовые задания с выбором одного правильного ответа
№ 1. В атоме химического элемента, проявляющего степень окисления –3 в водородном соединении, следующее распределение электронов: 1) 2e, 8e, 4e, 2) 2e, 8e, 6e, 3) 2e, 8e, 5e, 4) 2e, 8e, 3e.
№ 2. Выберите формулу высшего оксида и летучего водородного соединения элементов VIIA-группы. 1) ЭO3 и ЭН2, 2) Э2O7 и ЭН, 3) ЭO2 и ЭН4, 4) Э2O5 и ЭН3.
№ 3. Укажите вещество с атомной кристаллической решёткой. 1) кремнезём, 2) водород, 3) аммиак, 4) белый фосфор.
№ 4. Выберите пару «оксид — кислота», в которой оксид не соответствует кислоте. 1) SO3 и Н2SO4 2) SiO2 и Н2SiO33) N2O3 и HNO3 4) Р2O5 и Н3РO4
№ 5. Водород взаимодействует с каждым из двух веществ, формулы которых: 1) СО и Si, 2) O2 и CuО, 3) NН3 и Na, 4) S и КCl.
№ 6. В сосуд, изображённый на рисунке, можно собрать каждый из двух газов, формулы которых 1) СO2 и СН4, 2) O2 и NO2, 3) NН3 и O2, 4) SO2 и Н2
№ 7. Верны ли следующие суждения об аммиаке? А. Аммиак проявляет основные свойства. Б. Сырьём для получения аммиака в промышленности служат азот и водород. 1) верно только А, 2) верно только Б, 3) оба суждения верны, 4) оба суждения неверны.
№ 8. Сульфиды и сульфиты можно обнаружить с помощью реактива, формула которого 1) NaOH, 2) НCl, 3) Ca(NO3)2, 4) К2CO3
№ 9. В схеме превращений кремниевая кислота —> X —> силикат калия вещество X – это 1) оксид кремния 2) оксид калия 3) гидроксид калия 4) силан.
№ 10. В уравнении реакции Cl2 + 2NaBr = Br2 + 2NaCl окислитель — это![]()
Тестовые задании с выбором двух правильных ответов и на установление соответствия
№ 11. При производстве серной кислоты не используют следующие принципы химической технологии: 1) противоток, 2) понижение температуры, 3) циркуляцию, 4) теплообмен, 5) понижение давления.
№ 12. Установите соответствие между веществами и реактивом, с помощью которого их можно различить. ВЕЩЕСТВА: A) СаCl2 и NH4Cl Б) КCl и К2СO3B) Na2SO4 и Ba(NO3)2РЕАКТИВ: 1) CO2, 2) NaOH, 3) Н2SO4, 4) ВаCl2.
Часть 2. Задания с развёрнутым ответом
№ 13. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Р —> Mg3P2 —> РН3 —> Р3O5 —> Н3РO4
№ 14. При растворении технического цинка в избытке разбавленной соляной кислоты выделилось 3,1 л водорода (н. у.). Определите массовую долю примесей в атом образце цинка.
К-2 Вариант 4
Ответов НЕТ !
Вы смотрели: Контрольная работа по химии № 2 для 9 класса по теме «Неметаллы» по учебнику химии базового уровня Габриеляна, Остроумова и Сладкова. Цитаты из учебного пособия использованы в учебных целях. Код материалов: Химия 9 Габриелян Контрольная 2 (в 4-х вариантах).































