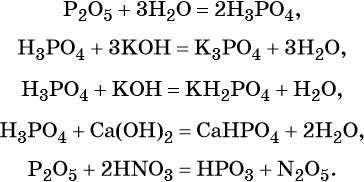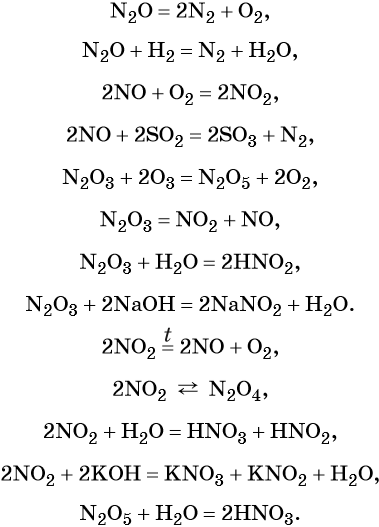Кислород
Химический элемент кислород расположен во 2-м периоде VIA подгруппе. Его электронная формула 1s22s22p4. Простое вещество кислород — газ без цвета и запаха, мало растворим в воде. Сильный окислитель. Его характерные химические свойства:
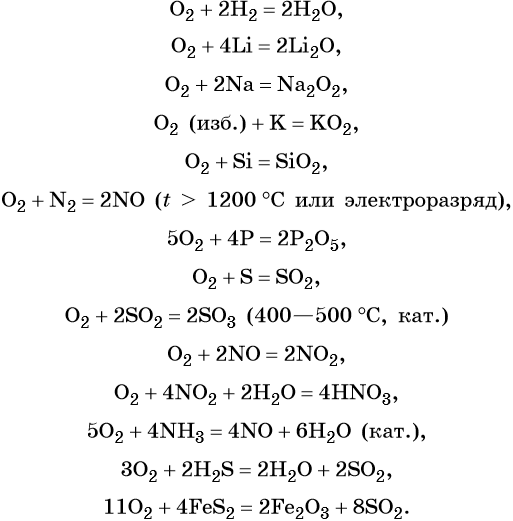
Реакции простых и сложных веществ с кислородом часто сопровождаются выделением тепла и света. Такие реакции называют реакциями горения.
Кислород широко используется практически во всех областях химической промышленности: для производства чугуна и стали, производства азотной и серной кислоты. Огромное количество кислорода потребляется в процессах тепловой энергетики.
В последние годы обострилась проблема сохранения запасов кислорода в атмосфере. До настоящего времени единственным источником, пополняющим запасы атмосферного кислорода, является жизнедеятельность зелёных растений.
Химические свойства и соединения
Водородные соединения неметаллов в основном являются летучими соединениями, в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом:
S+H2 =H2 S (до 350 градусов равновесие смещено вправо)
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.
Неметаллы взаимодействуют с металлами и другими неметаллами:
2Na+Cl2 =2NaCl
В результате получается натриевая соль соляной кислоты
Рис. 3. натриевая соль соляной кислоты.S+O2 =SO2
соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты. Структура оксидов типичных неметаллов молекулярная (SO3, P4 O10). Чем выше степень окисления неметалла, тем сильнее соответствующая оксокислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Неметаллы находят применение в разных отраслях промышленности. Вот список отраслей, где их использование является наиболее востребованным.
| Область применения | Примеры, перечень неметаллов, применяемых в той или иной промышленности |
| промышленность | Сера, азот и фосфор часто используют для получения кислот. Серу также используют на производстве резины. |
| транспорт | важным неметаллом в транспортной промышленности является водород. Его используют в качестве топлива. При сгорании такой вид топлива не загрязняет окружающую среду. |
| аграрная отрасль | сера используется для борьбы с вредными насекомыми и болезнями растений |
| медицина | Кислород используют для восстановления дыхания (кислородные подушки), уголь в форме активированного угля, который способен выводить из организма вредные вещества. |
| пищевая промышленность | азот используют для продления срока годности продуктов |
Что мы узнали?
В этой статье за 9 класс химии кратко излагается основная информация о неметаллах, их строении, и о том, с чем реагируют неметаллы. Неметаллами могут быть газы, жидкости и твердые вещества с кристаллической решеткой. Самым активным неметаллом является фтор, который имеет степень окисления-1.
-
/10
Вопрос 1 из 10
Общая характеристика
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода.
Рис. 1. Группа неметаллов в периодической системе.
Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома).
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами.
Азот
Химический элемент азот — находится во 2-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p3. В своих соединениях азот проявляет степени окисления –3, –2, +1,+2, +3, +4, +5.
Простое вещество азот — газ без цвета и запаха, малорастворимый в воде. Типичный неметалл. В обычных условиях химически мало активен. При нагревании вступает в окислительно-восстановительные реакции.
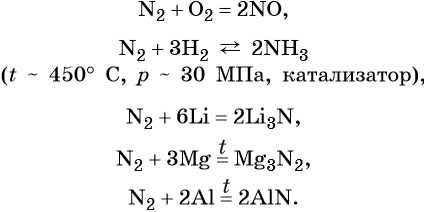
Азот образует оксиды состава N2O, NO, N2O3, NO2, N2O4, N2O5. При этом N2O, NO, являются несолеобразующими оксидами, для которых характерны окислительно-восстановительные реакции; N2O3, NO2, N2O4, N2O5 — солеобразующие кислотные оксиды, для которых также характерны окислительно-восстановительные реакции, в том числе реакции диспропорционирования.
Химические свойства оксидов азота:
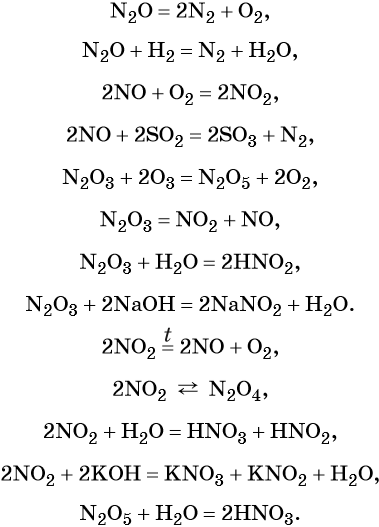
Азот образует летучее водородное соединение состава NH3, аммиак. При обычных условиях это бесцветный газ с характерным резким запахом; температура кипения –33,7 °C, температура плавления –77,8 °C. Аммиак хорошо растворим в воде (700 объёмов NH3 на 1 объём воды при 20 °C) и ряде органических растворителей (спирт, ацетон, хлороформ, бензол).
Химические свойства аммиака:
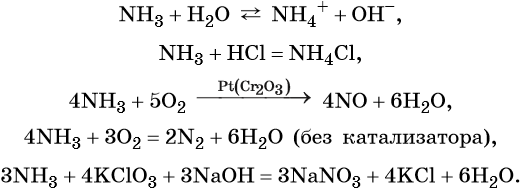
Азот образует азотистую кислоту HNO2 (в свободном виде известна только в газовой фазе или растворах). Это слабая кислота, её соли называют нитритами.
Кроме того, азот образует очень сильную азотную кислоту HNO3. Особенностью азотной кислоты является то, что при её окислительно-восстановительных реакциях с металлами не выделяется водород, а образуются различные оксиды азота или соли аммония, например:
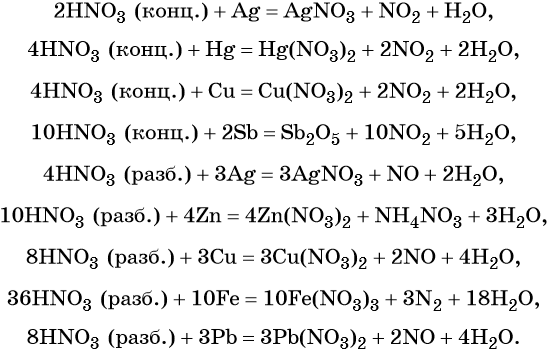
В реакциях с неметаллами концентрированная азотная кислота ведёт себя как сильный окислитель:
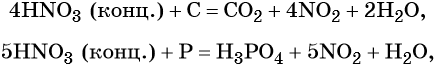
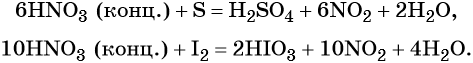
Также азотная кислота способна окислять сульфиды, йодиды и т. д.:
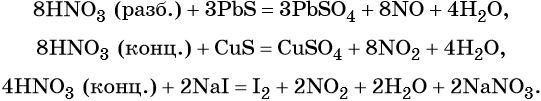
Подчеркнём ещё раз. Запись уравнений окислительно-восстановительных реакций с участием HNO3 обычно условна. Как правило, в них указывают лишь продукт, образующийся в большем количестве. В некоторых из таких реакций в качестве продукта восстановления обнаружен водород (реакция разбавленной HNO3 с Mg и Mn).
Соли азотной кислоты называют нитратами. Все нитраты хорошо растворимы в воде. Нитраты термически нестабильны и при нагревании легко разлагаются.
Особые случаи разложения нитрата аммония:
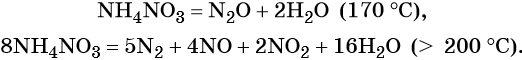
Общие закономерности термического разложения нитратов:
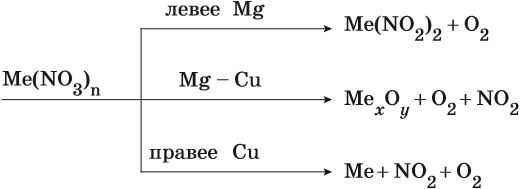
Сера
Химический элемент сера расположен в 3-м периоде VIA подгруппе. Его электронная формула 1s22s22p63s23p4. Простое вещество сера — неметалл жёлтого цвета. Существует в двух аллотропных модификациях: ромбическая и моноклинная и в аморфной форме (пластическая сера). Проявляет как окислительные, так и восстановительные свойства. Возможны реакции диспропорционирования. Её характерные химические свойства:

Сера образует летучее водородное соединение — сероводород. Его водный раствор представляет собой слабую двухосновную кислоту. Для сероводорода характерны также восстановительные свойства:
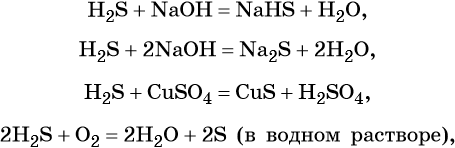
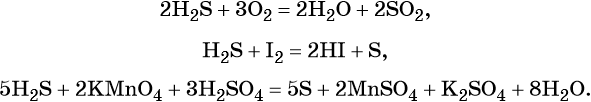
Сера образует два кислотных оксида: оксид серы (IV) SO2 и оксид серы (VI) SO3. Первому соответствует слабая, существующая только в растворе сернистая кислота H2SO3; второму — сильная двухосновная серная кислота H2SO4. Концентрированная серная кислота проявляет сильные окислительные свойства. Ниже приведены характерные для этих соединений реакции:
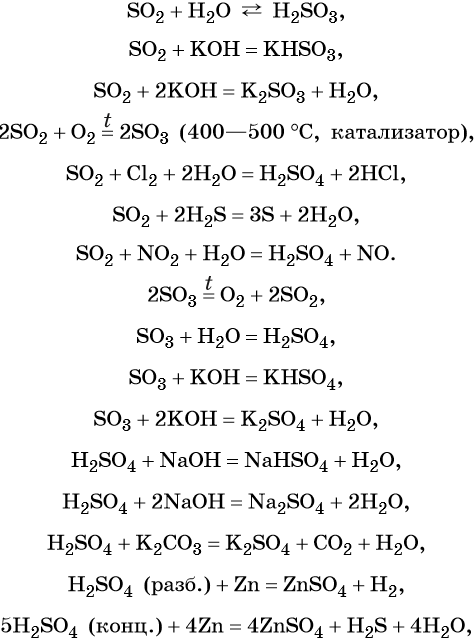
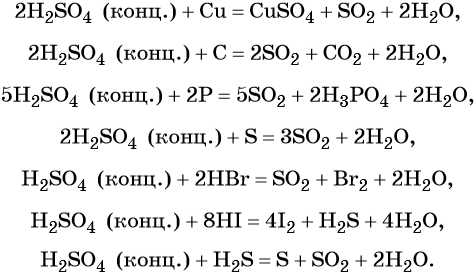
Серная кислота в больших количествах производится в промышленности. Все промышленные методы производства серной кислоты основаны на первоначальном получении оксида серы (IV), его окислении в оксид серы (VI) и взаимодействии последнего с водой.
Кремний
Химический элемент кремний находится в 3-м периоде IVА группе периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p2, наиболее характерные степени окисления –4, +4.
Кремний получают восстановлением его оксида магнием или углеродом в электрических печах, а кремний высокой чистоты — восстановлением SiCl4 цинком или водородом, например:
Кремний может существовать в кристаллической или аморфной форме. В обычных условиях кремний довольно устойчив, причём аморфный кремний более реакционноспособен, чем кристаллический. Для кремния наиболее устойчива степень окисления +4.
Реакции, характерные для кремния:
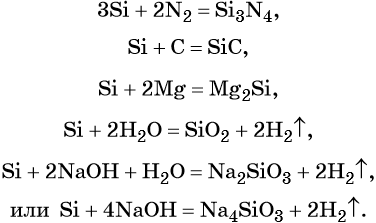
Кремний не реагирует с кислотами (за исключением HF), пассивируется кислотами-окислителями, но хорошо растворяется в смеси плавиковой и азотной кислот, что можно описать уравнением:
![]()
Оксид кремния (IV), SiO2 (кремнезём), в природе встречается в основном в виде минерала кварца. В химическом отношении довольно устойчив, проявляет свойства кислотного оксида.
Свойства оксида кремния (IV):
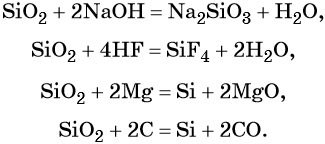
Кремний образует кислоты переменного содержания SiO2 и H2O. Соединение состава H2SiO3 в чистом виде не выделено, но для упрощения допускается его запись в уравнениях реакций:
![]()
Фосфор
Химический элемент фосфор расположен в 3-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p3.
Простое вещество фосфор существует в виде нескольких аллотропных модификаций (аллотропия состава). Белый фосфор Р4, при комнатной температуре мягкий, плавится, кипит без разложения. Красный фосфор Pn, состоит из полимерных молекул разной длины. При нагревании возгоняется. Чёрный фосфор состоит из непрерывных цепей Pn, имеет слоистую структуру, по внешнему виду похож на графит. Наиболее реакционноспособным является белый фосфор.
В промышленности фосфор получают прокаливанием фосфата кальция с углём и песком при 1500 °C:
![]()
В приведённые ниже реакции вступают любые модификации фосфора, если нет особых оговорок:
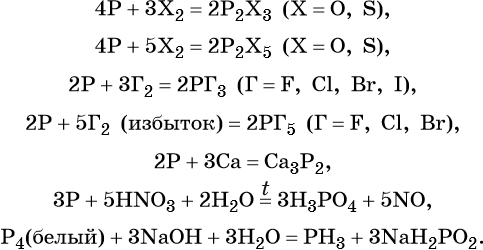
Фосфор образует летучее водородное соединение — фосфин, PH3. Это газообразное соединение с крайне неприятным резким запахом. Его соли в отличие от солей аммиака существуют только при низких температурах. Фосфин легко вступает в окислительно-восстановительные реакции:
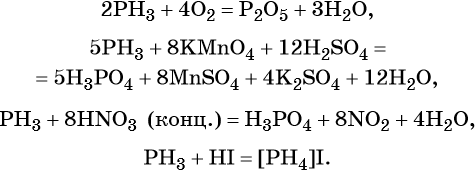
Фосфор образует два кислотных оксида: P2O3 и P2O5. Последнему соответствует фосфорная (ортофосфорная) кислота H3PO4. Это трёхосновная кислота средней силы, которая образует три ряда солей: средние (фосфаты) и кислые (гидро- и дигидрофосфаты). Ниже приведены уравнения химических реакций, характерные для данных соединений: