Соединения серы: серная кислота
Ключевые слова конспекта: соединения серы, серная кислота, участие в кислотно-основных и окислительно-восстановительных взаимодействиях, получение и применение серной кислоты.
Серная кислота H2SO4 – вещество молекулярного строения. Её графическая формула:
В серной кислоте сера находится в высшей степени окисления +6.
Серная кислота представляет собой бесцветную маслянистую жидкость, хорошо растворимую в воде. Смешивается с водой в неограниченном количестве и очень гигроскопична. При растворении верной кислоты в воде выделяется значительное количество теплоты.
Химические свойства серной кислоты можно рассмотреть с точки зрения кислотно-основных и окислительно-восстановительных взаимодействий.
Участие в кислотно-основных взаимодействиях
- Серная кислота – сильный электролит, в водных растворах диссоциирует практически полностью:
Изменяет окраску индикатора (например, лакмуса с фиолетовой на красную).
Более корректно электролитическая диссоциация H2SO4 описывается уравнениями:
- Серная кислота реагирует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O2Н+ + CuO = Cu2+ + H2O
- Серная кислoта реагирует с основаниями и амфотерными гидроксидами:
H2SO4 + Cu(OH)2 = CuSO4 + 2H202Н+ + Cu(OH)2 = Cu2+ + 2H20
- Сернaя кислота вытесняет более слабые кислоты из их солей:
- Сeрная кислота вытесняет и сильные, но летучие кислоты из их солей:
Участие в окислительно-восстановительных взаимодействиях
Разбавленные растворы H2SO4 реагируют с металлами, расположенными в электрохимическом ряду напряжений металлов до H2, с образованием сульфатов и выделением водорода:
Чистая H2SO4 и H2SO4 в концентрированных растворах проявляют сильные окислительные свойства за счёт S+6.
Концентрированная H2SO4 взаимодействует с металлами (в том числе с Cu, Ag, Hg), стоящими после H2 в ряду напряжений металлов, с образованием сульфатов, воды и продуктов восстановления S+6: H2S, S, SO2. Концентрированная серная кислота не реагирует с благородными металлами вследствие их малой активности, а также с Al, Cr, Fe из-за пассивации. На поверхности этих металлов образуется защитная оксидная плёнка, защищающая их от дальнейшего окисления.
Глубина восстановления зависит от восстановительных свойств металлов.
Активные металлы восстанавливают H2SO4 до H2S:
Металлы с меньшей активностью восстанавливают H2SO4 до SO2:
Концентрированная сeрная кислoта окисляет и некоторые неметаллы. Например:
Важной химической особенностью серной кислоты является её способность выступать в качестве дегидратирующего реагента. Концентрированная серная кислота вступает в реакции дегидратации со многими органическими веществами, отщепляя от них молекулы воды
Например:
Получение и применение серной кислоты
Промышленное получение серной кислоты включает несколько стадий. Сырьём является сера S и сульфидные руды (в основном пирит FeS2).
В ходе получения серной кислоты из пирита осуществляются три химические реакции:
- Обжиг пирита (проводится при температуре около 800 °С):
- Каталитическое окисление оксида серы (IV):
Эта реакция – обратимая, экзотермическая, каталитическая (её проводят в присутствии катализатора V2O5 при температуре около 450 °С).
Оксид серы (VI) (серный ангидрид) SO3 при обычных условиях – летучая жидкость (t°кип. = 44,8 °С), неограниченно растворяется в воде. Оксид серы (VI) SO3 – кислотный оксид, ему соответствует сильная серная кислота.
- Поглощение SO3 водой (гидратация SO3): SO3 + H2O = H2SO4
В промышленности для этой реакции используют концентрированную H2SO4, образуется олеум H2SO4 • SO3, при разбавлении которого получают концентрированную H2SO4.
Серная кислота – один из важнейших продуктов химической промышленности. Важнейшие области её применения: производство минеральных удобрений, других кислот и солей, красителей, пластмасс, волокон, лекарственных веществ, очистка нефтепродуктов, металлургия.
Конспект урока «Соединения серы: серная кислота». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Похожие ГДЗ Химия 9 класс
Решебник №2
Предыдущее
Следующее
Легче освоить сложный материал девятикласснику поможет «ГДЗ по химии 9 класс учебник Габриелян (Просвещение)». Решебник дает не только верные ответы на сложные задания, но и помогает понять логику решений, что значительно облегчит анализ аналогичных задач.
Преимущества решебника в изучении химии
Учебный материал в девятом классе нельзя назвать легким. Понимание большинства тем учебника требует очень больших затрат времени. Иногда без посторонней помощи просто невозможно разобраться, особенно если по какой-то причине урок был пропущен или учитель не смог доходчиво объяснить материал. Также у школьника может остро стоять необходимость в более углублённом изучении химии как науки. Во всех перечисленных случаях использование ГДЗ просто незаменимо, так как решебник обеспечивает:
- Возможность самопроверки на всех этапах обучения.
- Повышение успеваемости и получение максимального бала по химии.
- Оперативность в систематизированных данных.
- Консолидацию в одном пособии всех заданий и анализ их решений.
Кроме этого решебник доступен круглосуточно в режиме онлайн.
Описание ГДЗ
Содержание «ГДЗ по химии 9 класс учебник Габриелян О.С., Остроумов И.Г., Сладков С.А. (Просвещение)» полностью соответствует всем разделам учебника и включает в себя:
- ответы на вопросы ко всем параграфам;
- подробное описание выполнения лабораторных работ, которые включены в программу девятого класса;
- каждое решение содержит необходимые дополнительные справочные данные.
Информация решебника имеет удобный для восприятия формат и значительно упростит школьникам как выполнение домашнего задания, так и подготовку к различным видам оценивания знаний.
Презентация на тему: » Серная кислота (к рабочей тетради О.Г. Габриеляна «Химия- 9 класс» Составитель: Малышева А.А. -учитель химии высшей категории «МАОУ гимназия 1»» — Транскрипт:
1
Серная кислота (к рабочей тетради О.Г. Габриеляна «Химия- 9 класс» Составитель: Малышева А.А. -учитель химии высшей категории «МАОУ гимназия 1»

2
С помощью каких реакций можно осуществить превращения: S H 2 S S SO 2 Na 2 SO 3 SO 2 SO 3 H 2 SO 4

3
S H 2 S 1) S 0 + H 2 0 = H 2 +1 S -2
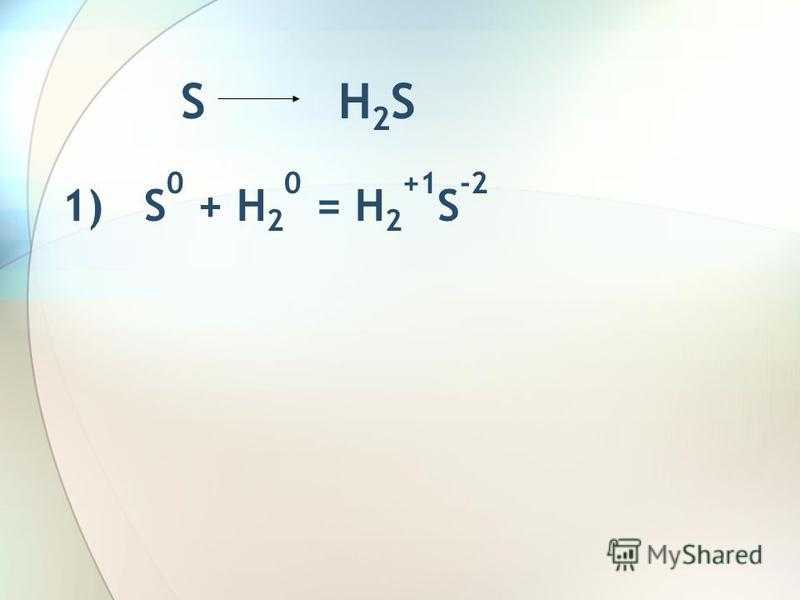
4
H 2 S S 2) 2H 2 S -2 + O 2 0 = 2H 2 O -2 +2S 0 H 2 S -2 + I 2 0 = S 0 + 2HI -1

5
S SO 2 3) S 0 + O 2 0 = S +4 O 2 -2
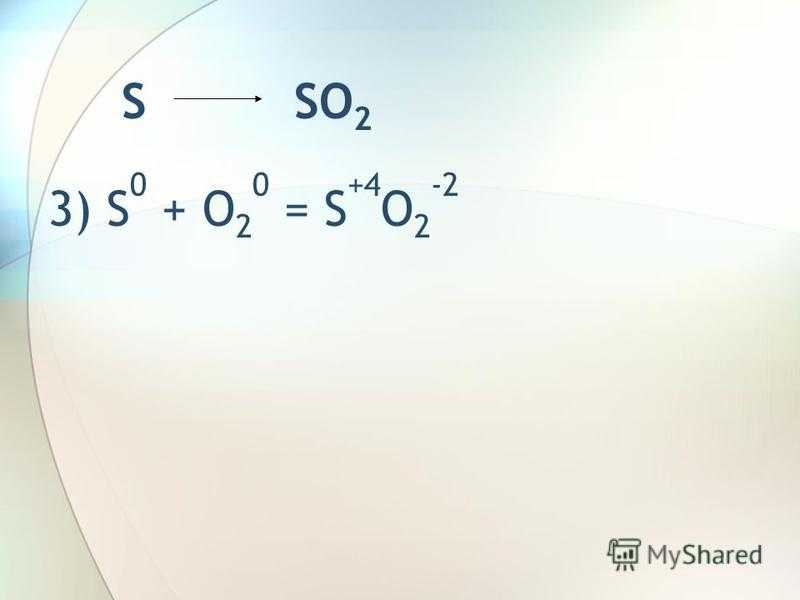
6
SO 2 Na 2 SO 3 4) SO 2 + Na 2 O = Na 2 SO 3 SO 2 + 2NaOH + Na 2 SO 3 + H 2 O
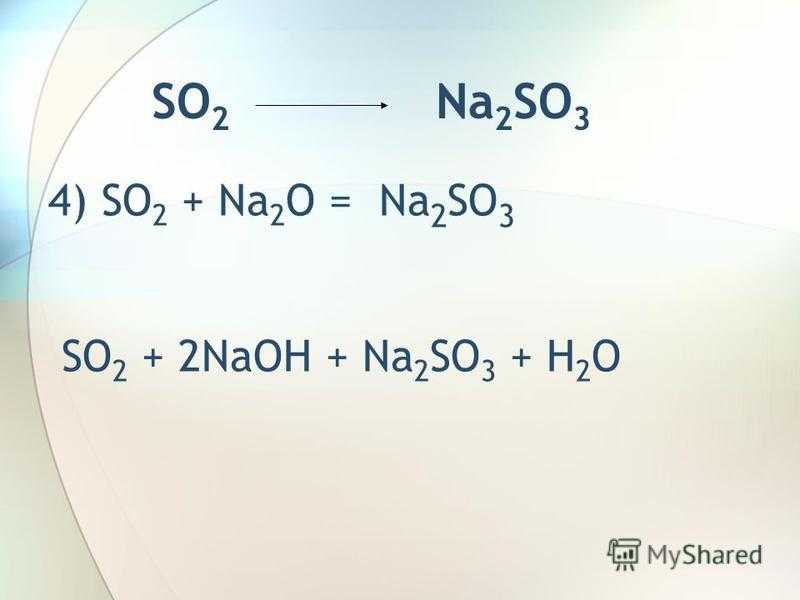
7
Na 2 S0 3 SO 2 5) Na 2 SO 3 + 2HCl = 2NaCl + SO 2 + H 2 O
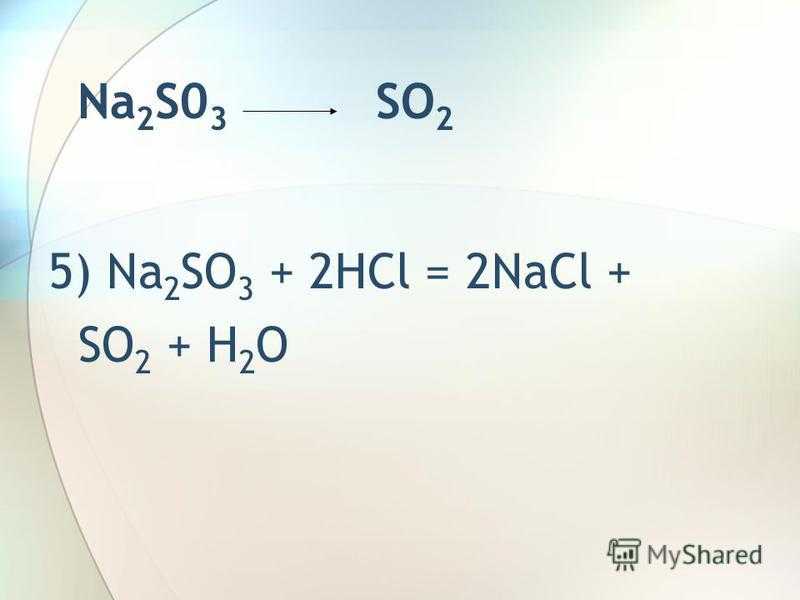
8
SO 2 SO 3 6) S +4 O 2 +O 2 0 = S +6 O 3 -2
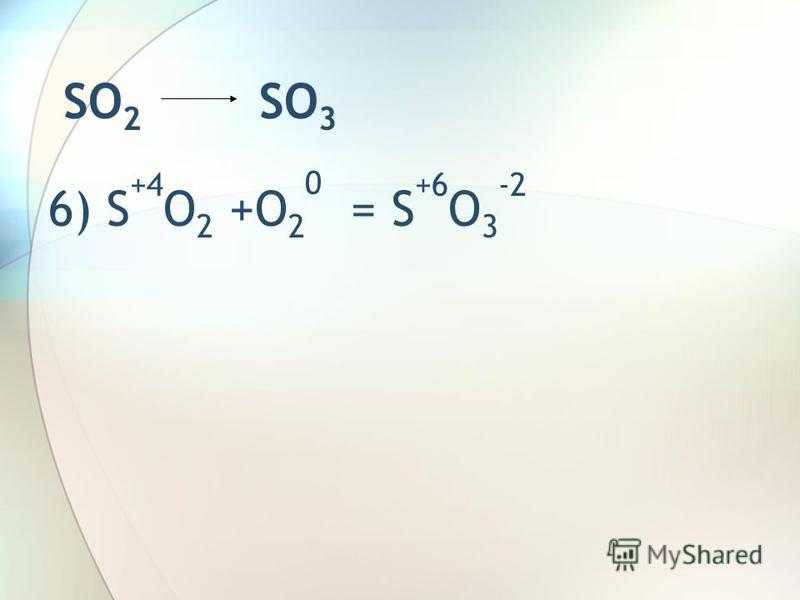
9
SO 3 H 2 SO 4 7) SO 3 + H 2 O = H 2 SO 4
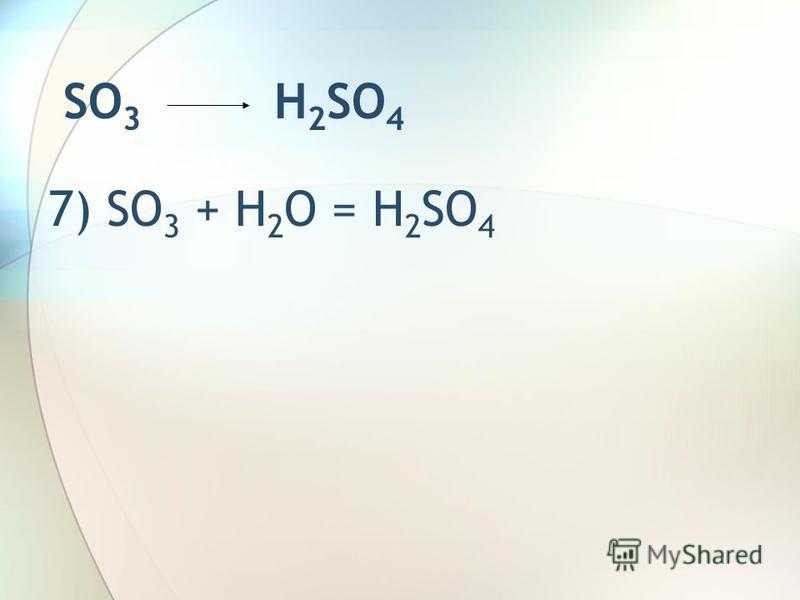
10
Серная кислота

11
H2 S O4H2 S O

12
Применение H 2 SO 4

13
CuSO 4 *5H 2 O

14
Применение H 2 SO 4 красители

15
Применение H 2 SO 4 пластмассы

16
Применение H 2 SO 4

17
ГИПС

18
Применение H 2 SO 4 Лекарства

19
Применение H 2 SO 4 Взрывчатые вещества

20
Применение H 2 SO 4

21
Задачи урока -изучить свойства разаавленной серной кислоты -изучить свойства концентрированной серной кислоты -установить взаимосвязь свойств кислоты и областей её применения

22
СЕРНАЯ КИСЛОТА Химические свойства Физические свойства Применение серной кислоты Задачи

23
Тяжелая маслянистая жидкость без запаха Не проводит электрический ток гигроскопичность нелетучая Физические свойства серной кислоты H 2 SO 4 Проводит электрический ток
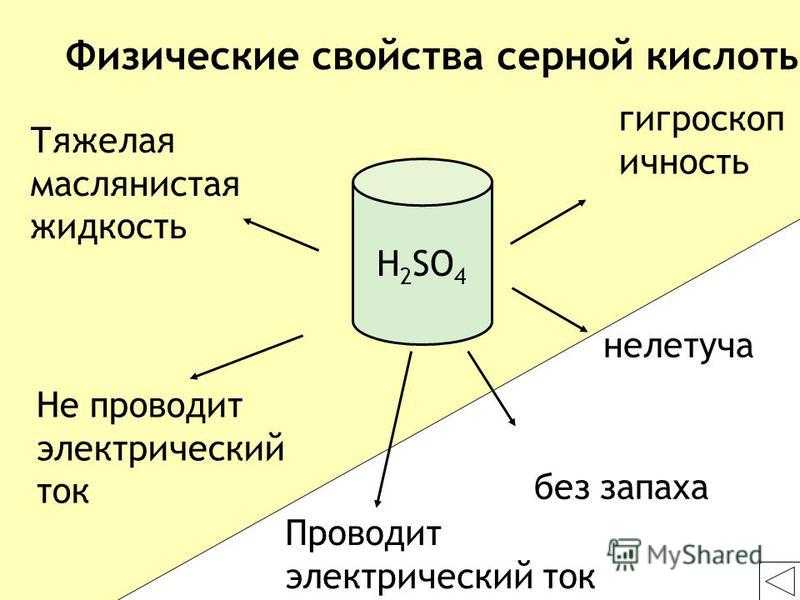
24
H2 S O4H2 S O

25
Химические свойства H 2 SO 4 Разбавленная Концентрированная
26
Химические свойства разаавленной серной кислоты 1 ) С основаниями 2) С основными оксидами 3 ) С растворами солей ( качественная реакция) 4)С металлами,стоящими в ряду активности до водорода ( исключение- свинец)

27
Взаимодействие разаавленной серной кислоты с основаниями H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O

28
Взаимодействие разаавленной серной кислоты с основными оксидами 3H 2 SO 4 + Fe 2 O 3 = Fe 2 (SO 4 ) 3 +3H 2 O

29
Взаимодействие разаавленной серной кислоты с растворами солей H 2 SO 4 + Na 2 CO 3 = CO 2 +H 2 O +Na 2 SO 4

30
КАЧЕСТВЕННЫЕ РЕАКЦИИ — это реакции, с помощью которых распознают определенные химические вещества

31
Качественная реакция на сульфат-ион Ba 2+ + SO 4 2- = BaSO 4

32
ПРОВЕРЬ СЕБЯ: Ba 2+ +2Cl — +2H + +SO 4 2- =BaSO 4 +2H + +2Cl — Ba 2+ +SO 4 2- =BaSO 4 BaCl 2 +H 2 SO 4 =BaSO 4 +2HCl

33
Zn 0 +H 2 +1 SO 4 = Zn +2 SO 4 +H 2 0 ОКИСЛИТЕЛЬ — Н + Взаимодействие разаавленной серной кислоты с металлами

34
Химические свойства концентрированной серной кислоты Сильный окислитель Гигроскопичность
35
Сильный окислитель а) H 2 S +6 O 4 + Mg 0 = H 2 S -2 + Mg +2 SO 4 + Н 2 О б) H 2 S +6 O 4 + Zn 0 = S 0 + Zn +2 SO 4 + Н 2 О в) H 2 S +6 O 4 + Cu 0 = S +4 O 2 + Cu +2 SO 4 + Н 2 О г) C 0 +2H 2 S +6 O 4 = C +4 O 2 +2S +4 O 2 + 2H 2 O ОКИСЛИТЕЛЬ – S +6 O 4

36
Обугливание сахара концентрированной серной кислотой C 11 H 22 O 11 + H 2 SO4 = 12C + H 2 SO H 2 O + SO 2

37
H 2 SO 4 +nH 2 O = H 2 SO 4 nH 2 O +Q Гигроскопичность

38
Как приготовить раствор серной кислоты? Техника безопасности

39
H 2 SO 4 Добавить воду в кислоту ? H2OH2O Посмотреть

40
H 2 SO 4 Добавить воду в кислоту ? H2OH2O

41
H 2 SO 4 Добавить воду в кислоту ?

42
H 2 SO 4 Добавить воду в кислоту ?

43
H 2 SO 4 Добавить воду в кислоту ?

44
H 2 SO 4 Добавить воду в кислоту ?

45
H 2 SO 4 Добавить воду в кислоту ?

46
H 2 SO 4 Добавить воду в кислоту ?

47
H 2 SO 4 Добавить воду в кислоту ?

48
H 2 SO 4 Добавить воду в кислоту ?

49
H 2 SO 4 Добавить воду в кислоту ?

50
H 2 SO 4 Добавить воду в кислоту ?

51
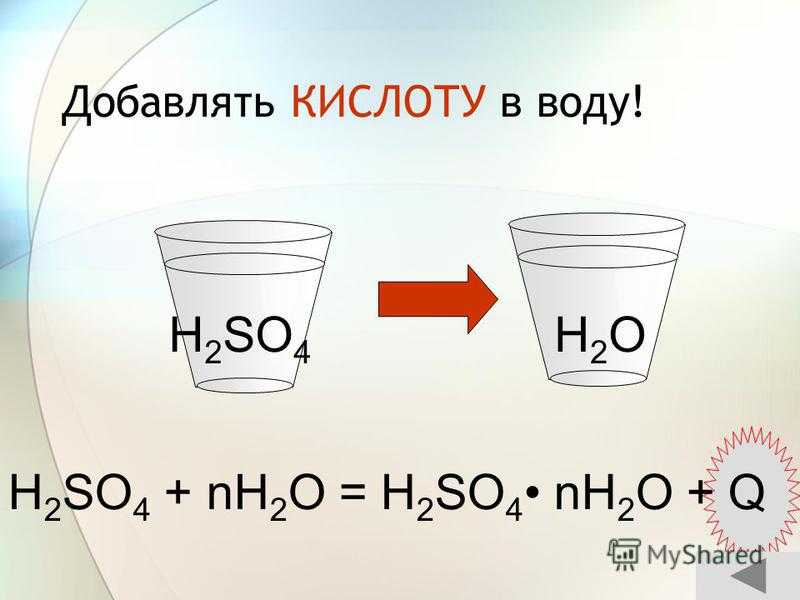
Добавлять КИСЛОТУ в воду! H 2 SO 4 + nH 2 O = H 2 SO 4 nH 2 O + Q H2OH2OH 2 SO 4
52
Экспериментальная задача H 2 SO 4 (раза)? H 2 SO 4 (конц)? Zn

53
ПРОВЕРЯЕМ 5H 2 S +6 O 4 + 4Mg 0 = 4 Mg +2 SO 4 + H 2 S H 2 O Ок-ль S е S -2 1 восстановил. 8 В-ль Mg 0 – 2 е Mg +2 4 окисление

54
ПРОВЕРЯЕМ 4H 2 S +6 O 4 +3 Zn 0 3 Zn +2 SO 4 + 4H 2 O + S 0 Ок-ль S е S 0 1 восстановил. 6 В-ль Zn 0 – 2 е Zn +2 3 окисление

55
ПРОВЕРЯЕМ 2H 2 S +6 O 4 + Cu 0 Cu +2 SO 4 + S +4 O 2 + 2H 2 O В-ль Cu 0 – 2 е Сu +2 1 окисление 2 о-ль S е S 0 1 восстановил.

56
Домашнее задание Прочитать текст учебника на стр В рабочей тетради закончить упражнения (кроме упражнения на производство серной кислоты). К следующему уроку подготовить рассказ о свойствах разаавленной и концентрированной серной кислот.

Слайды и текст этой презентации
H2S S SO2
Na2SO3 SO2 SO3 H2SO4
Слайд 3 S
H2S 1) S0 + H20 = H2+1S-2
Слайд 4 H2S S
2) 2H2S-2+ O20= 2H2O-2+2S0
H2S-2+ I20 = S0 + 2HI-1
Слайд 5 S SO23) S0
+ O20 = S+4O2-2
Слайд 6 SO2
Na2SO34) SO2 + Na2O = Na2SO3
SO2 + 2NaOH + Na2SO3 + H2O
Слайд 7 Na2S03 SO25) Na2SO3 + 2HCl
= 2NaCl + SO2
+ H2O
Слайд 8 SO2 SO36) S+4O2 +O20 = S+6O3-2
Слайд 9 SO3 H2SO47) SO3 + H2O
= H2SO4
Слайд 12Применение
H2SO4
Слайд 13Применение
H2SO4CuSO4*5H2O
Слайд 14Применение
H2SO4красители
Слайд 15Применение
H2SO4пластмассы
Слайд 16Применение
H2SO4
Слайд 17Применение
H2SO4ГИПС
Слайд 18Применение
H2SO4Лекарства
Слайд 19Применение
H2SO4Взрывчатые вещества
Слайд 20Применение
H2SO4в качестве осушителя
Слайд 21 Задачи урока -изучить свойства
и областей её применения
кислотыH2SO4Проводит электрический ток
Слайд 25Химические свойства
H2SO4РазбавленнаяКонцентрированная
Слайд 26 Химические свойства
разбавленной серной кислоты
1) С основаниями2) С основными
оксидами
3) С растворами солей( качественная реакция)
4)С металлами ,стоящими в ряду активности до водорода ( исключение- свинец)
Слайд 27Взаимодействие разбавленной серной кислоты с основаниямиH2SO4 + 2NaOH = Na2SO4
+ 2H2O
Слайд 28Взаимодействие разбавленной серной кислоты с основными оксидами3H2SO4 + Fe2O3 =
Fe2(SO4)3 +3H2O
Слайд 29Взаимодействие разбавленной серной кислоты с растворами солейH2SO4 + Na2CO3 =
CO2 +H2O +Na2SO4
химические вещества
Слайд 32ПРОВЕРЬ СЕБЯ:Ba2++2Cl-+2H++SO42-=BaSO4 +2H++2Cl-
Слайд 33 Zn0 +H2+1SO4 =
Zn+2SO4 +H20
ОКИСЛИТЕЛЬ — Н+
Взаимодействие разбавленной серной кислоты с металлами
Слайд 35Сильный окислительа) H2S+6O4 + Mg0 = H2S-2 + Mg+2SO4
+ Н2Об) H2S+6O4 + Zn0 = S0 + Zn+2SO4 +
Н2Ов) H2S+6O4 + Cu0 = S+4O2 + Cu+2SO4 + Н2Ог) C0 +2H2S+6O4 = C+4O2 +2S+4O2 + 2H2O
ОКИСЛИТЕЛЬ – S+6O4
Слайд 36Обугливание сахара концентрированной
серной кислотойC11H22O11 + H2SO4 = 12C
+ H2SO4 . 11 H2O + SO2
Слайд 37 H2SO4 +nH2O = H2SO4
nH2O +QГигроскопичность
Слайд 51 Добавлять КИСЛОТУ в воду!H2SO4 + nH2O = H2SO4• nH2O
+ QH2OH2SO4
Слайд 52 Экспериментальная задачаZn
Слайд 53 ПРОВЕРЯЕМ5H2S+6O4+ 4Mg0 = 4 Mg+2SO4
+ H2S2 -+4H2O Ок-ль S+6 + 8е
S-2 1 восстановл. 8В-ль Mg0 – 2е Mg+2 4 окисление
Слайд 54 ПРОВЕРЯЕМ4H2S+6O4 +3 Zn0
3 Zn+2SO4 + 4H2O + S0Ок-ль S+6 +6е
S0 1 восстановл. 6В-ль Zn0 – 2е Zn+2 3 окисление
Слайд 55 ПРОВЕРЯЕМ2H2S+6O4 + Cu0
Cu+2SO4 + S+4O2 + 2H2OВ-ль Cu0 – 2е
Сu+2 1 окисление 2о-ль S+6 + 2е S0 1 восстановл.
Слайд 56 Домашнее заданиеПрочитать текст учебника на
стр.101-104В рабочей тетради закончить упражнения (кроме упражнения на производство серной кислоты).К следующему уроку подготовить рассказ о свойствах разбавленной и концентрированной серной кислот.
Общее описание
Серная кислота (H2SO4) обладает характерными свойствами кислот и является сильным окислителем. Это наиболее активная неорганическая кислота с температурой плавления 10°C. Кислота закипает при 296°C с выделением воды и оксида серы SO3. Способна поглощать пары воды, поэтому её используют для осушения газов.
Рис. 1. Серная кислота.
Серную кислоту получают промышленным путём из диоксида серы (SO2), который образуется при горении серы или серного колчедана. Два основных способа образования кислоты:
-
контактный (концентрация 94 %) – окисление диоксида серы до трёхокиси серы (SO3) с последующим гидролизом:
2SO2 + O2 → 2SO3; SO3 + H2O → H2SO4; -
нитрозный (концентрация 75 %) – окисление диоксидом азота диоксида серы при взаимодействии воды:
SO2 + NO2 + H2O → H2SO4 + NO.
Раствор SO3 в серной кислоте называется олеумом. Его также используют для получения серной кислоты.
Рис. 2. Процесс получения серной кислоты.
Реакция с водой способствует выделению большого количества тепла. Поэтому к воде примешивают кислоту, а не наоборот. Вода легче кислоты, она остаётся на поверхности. Если добавить воду в кислоту, вода мгновенно закипит, что приведёт к разбрызгиванию кислоты.





















