Свойства
Серная кислота образует два вида солей:
- кислые – гидросульфаты (NaHSO4, KHSO4);
- средние – сульфаты (BaSO4, CaSO4).
Химические свойства концентрированной серной кислоты представлены в таблице.
|
Реакция |
Что образуется |
Пример |
|
С металлами |
– Соль; – вода; – оксид серы; – сера; – сероводород |
– С активными: 2H2SO4 + Mg → MgSO4 + SO2 + 2H2O – с металлами средней активности: 4H2SO4 + 2Cr → Cr2(SO4)3 + 4H2O + S; – с малоактивными: 2H2SO4 + Cu → CuSO4 + SO2 + 2Н2О |
|
С неметаллами |
– Кислота; – вода; – оксид серы |
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
|
С оксидами |
– Соль; – вода; – оксид серы |
– Металлов: H2SO4 + CuO → CuSO4 + H2O; – неметаллов: H2SO4 + CO → CO2 + SO2 + H2O |
|
С основаниями |
– Соль; – вода |
H2SO4 + 2NaOH → Na2SO4 + 2H2O |
|
С солями |
– Соль; – углекислый газ; – вода; – кислота |
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O Качественная реакция: H2SO4 + BaCl2 → BaSO4 (белый осадок) + 2HCl |
|
Окисление сложных веществ |
– Свободные галогены; – оксид серы; – вода |
H2SO4 + 2HBr → Br2 + SO2 + 2H2O; H2SO4 + 2HI → I2 + 2H2O + SO2 |
|
Обугливание сахаров (целлюлозы, крахмала, глюкозы) |
– Оксид серы; – углекислый газ; – вода |
Рис. 3. Реакция с сахаром.
Разбавленная кислота не окисляет малоактивные металлы, стоящие в электрохимическом ряду после водорода. При взаимодействии с активными металлами (литием, калием, натрием, магнием) выделяется водород и образуется соль. Концентрированная кислота проявляет окислительные свойства с тяжёлыми, щелочными и щелочноземельными металлами при нагревании. Отсутствует реакция с золотом и платиной.
Серная кислота (разведённая и концентрированная) на холоде не взаимодействует с железом, хромом, алюминием, титаном, никелем. Благодаря пассивации металлов (образования защитной оксидной плёнки) серную кислоту можно перевозить в металлических цистернах. Оксид железа разрушается при нагревании.
Что мы узнали?
Из урока 9 класса узнали о свойствах серной кислоты. Это мощный окислитель, вступающий в реакции с металлами, неметаллами, органическими соединениями, солями, основаниями, оксидами. При взаимодействии с водой выделяется тепло. Получают серную кислоту из оксида серы. Концентрированная кислота без нагревания не взаимодействует с некоторыми металлами, что позволяет перевозить кислоту в металлической таре.
-
/5
Вопрос 1 из 5
Общее описание
Серная кислота (H2SO4) обладает характерными свойствами кислот и является сильным окислителем. Это наиболее активная неорганическая кислота с температурой плавления 10°C. Кислота закипает при 296°C с выделением воды и оксида серы SO3. Способна поглощать пары воды, поэтому её используют для осушения газов.
Рис. 1. Серная кислота.
Серную кислоту получают промышленным путём из диоксида серы (SO2), который образуется при горении серы или серного колчедана. Два основных способа образования кислоты:
-
контактный (концентрация 94 %) – окисление диоксида серы до трёхокиси серы (SO3) с последующим гидролизом:
2SO2 + O2 → 2SO3; SO3 + H2O → H2SO4; -
нитрозный (концентрация 75 %) – окисление диоксидом азота диоксида серы при взаимодействии воды:
SO2 + NO2 + H2O → H2SO4 + NO.
Раствор SO3 в серной кислоте называется олеумом. Его также используют для получения серной кислоты.
Рис. 2. Процесс получения серной кислоты.
Реакция с водой способствует выделению большого количества тепла. Поэтому к воде примешивают кислоту, а не наоборот. Вода легче кислоты, она остаётся на поверхности. Если добавить воду в кислоту, вода мгновенно закипит, что приведёт к разбрызгиванию кислоты.
Слайды и текст этой презентации

H2S S SO2
Na2SO3 SO2 SO3 H2SO4
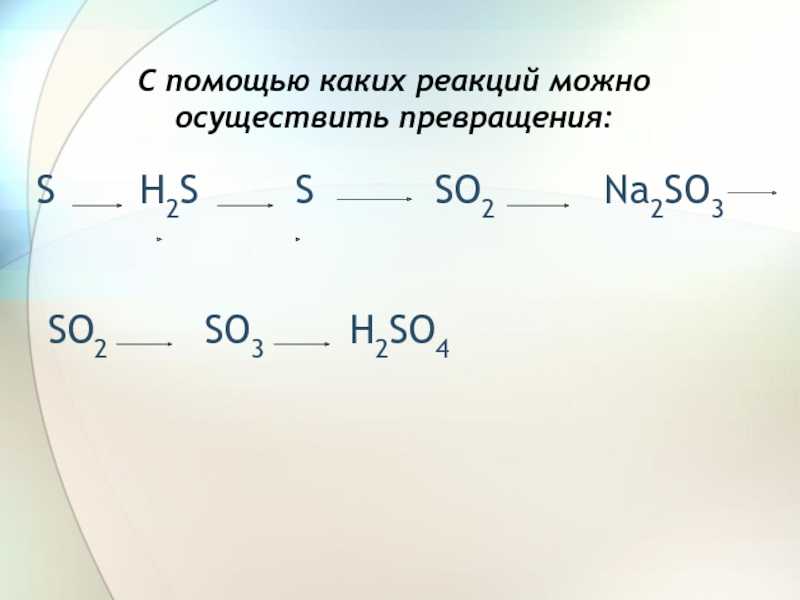
Слайд 3 S
H2S 1) S0 + H20 = H2+1S-2
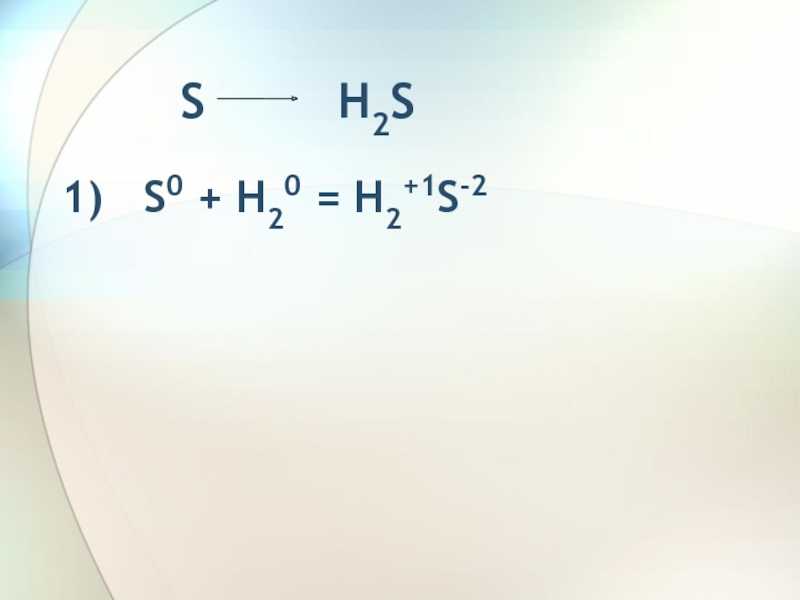
Слайд 4 H2S S
2) 2H2S-2+ O20= 2H2O-2+2S0
H2S-2+ I20 = S0 + 2HI-1
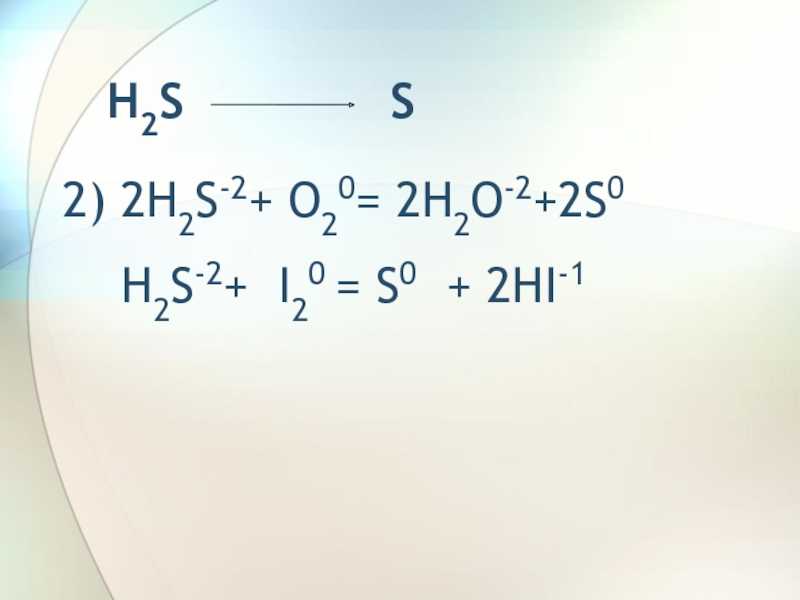
Слайд 5 S SO23) S0
+ O20 = S+4O2-2
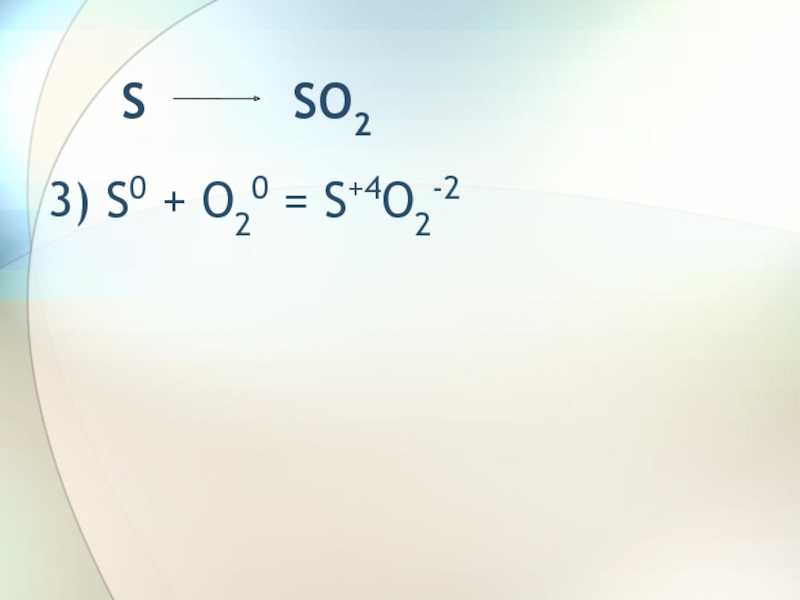
Слайд 6 SO2
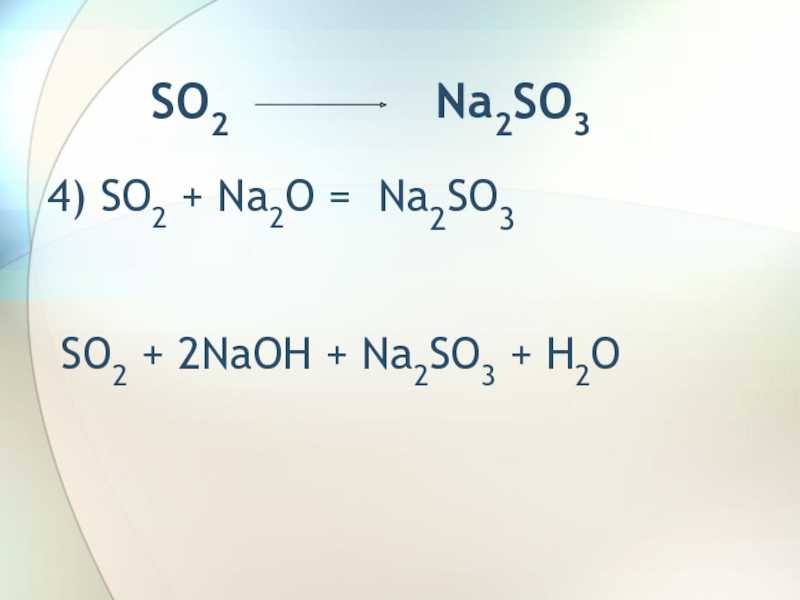
Na2SO34) SO2 + Na2O = Na2SO3
SO2 + 2NaOH + Na2SO3 + H2O
Слайд 7 Na2S03 SO25) Na2SO3 + 2HCl
= 2NaCl + SO2
+ H2O
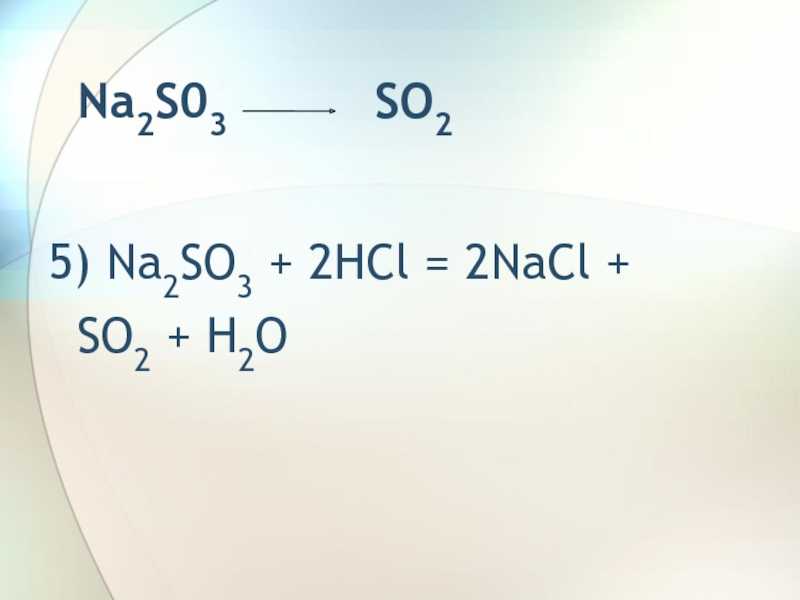
Слайд 8 SO2 SO36) S+4O2 +O20 = S+6O3-2
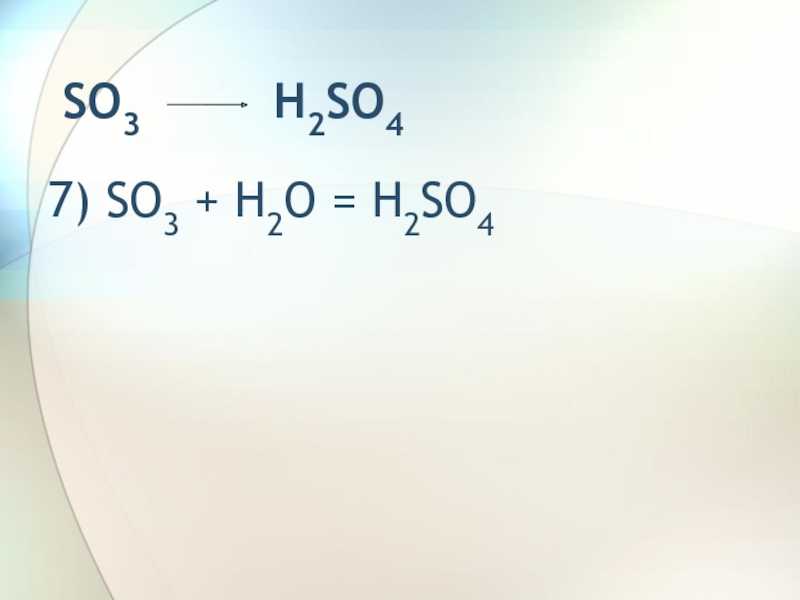
Слайд 9 SO3 H2SO47) SO3 + H2O
= H2SO4
Слайд 12Применение
H2SO4
Слайд 13Применение
H2SO4CuSO4*5H2O
Слайд 14Применение
H2SO4красители
Слайд 15Применение
H2SO4пластмассы
Слайд 16Применение
H2SO4
Слайд 17Применение
H2SO4ГИПС
Слайд 18Применение
H2SO4Лекарства
Слайд 19Применение
H2SO4Взрывчатые вещества
Слайд 20Применение
H2SO4в качестве осушителя
Слайд 21 Задачи урока -изучить свойства
и областей её применения

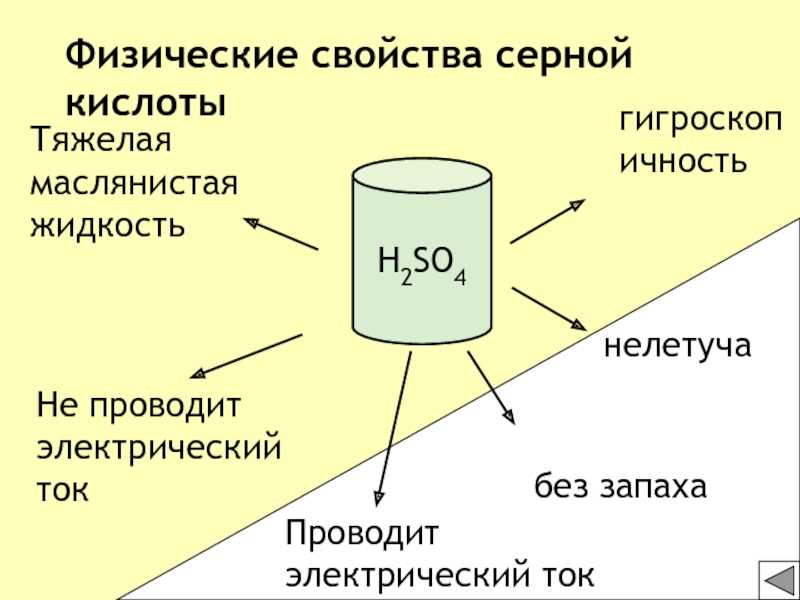
кислотыH2SO4Проводит электрический ток
Слайд 25Химические свойства
H2SO4РазбавленнаяКонцентрированная
Слайд 26 Химические свойства
разбавленной серной кислоты
1) С основаниями2) С основными
оксидами
3) С растворами солей( качественная реакция)
4)С металлами ,стоящими в ряду активности до водорода ( исключение- свинец)

Слайд 27Взаимодействие разбавленной серной кислоты с основаниямиH2SO4 + 2NaOH = Na2SO4
+ 2H2O

Слайд 28Взаимодействие разбавленной серной кислоты с основными оксидами3H2SO4 + Fe2O3 =
Fe2(SO4)3 +3H2O

Слайд 29Взаимодействие разбавленной серной кислоты с растворами солейH2SO4 + Na2CO3 =
CO2 +H2O +Na2SO4

химические вещества

Слайд 32ПРОВЕРЬ СЕБЯ:Ba2++2Cl-+2H++SO42-=BaSO4 +2H++2Cl-
Слайд 33 Zn0 +H2+1SO4 =
Zn+2SO4 +H20
ОКИСЛИТЕЛЬ — Н+
Взаимодействие разбавленной серной кислоты с металлами

Слайд 35Сильный окислительа) H2S+6O4 + Mg0 = H2S-2 + Mg+2SO4
+ Н2Об) H2S+6O4 + Zn0 = S0 + Zn+2SO4 +
Н2Ов) H2S+6O4 + Cu0 = S+4O2 + Cu+2SO4 + Н2Ог) C0 +2H2S+6O4 = C+4O2 +2S+4O2 + 2H2O
ОКИСЛИТЕЛЬ – S+6O4

Слайд 36Обугливание сахара концентрированной
серной кислотойC11H22O11 + H2SO4 = 12C
+ H2SO4 . 11 H2O + SO2

Слайд 37 H2SO4 +nH2O = H2SO4
nH2O +QГигроскопичность

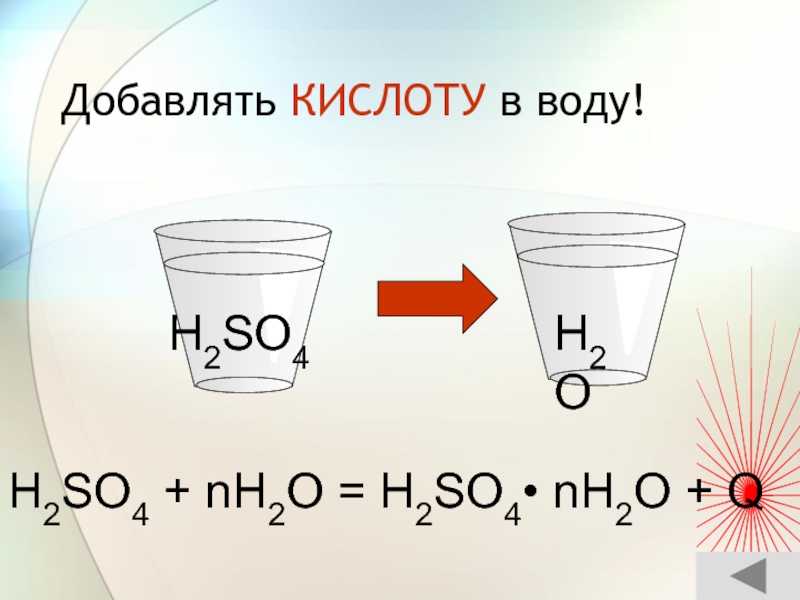
Слайд 51 Добавлять КИСЛОТУ в воду!H2SO4 + nH2O = H2SO4• nH2O
+ QH2OH2SO4
Слайд 52 Экспериментальная задачаZn
Слайд 53 ПРОВЕРЯЕМ5H2S+6O4+ 4Mg0 = 4 Mg+2SO4
+ H2S2 -+4H2O Ок-ль S+6 + 8е
S-2 1 восстановл. 8В-ль Mg0 – 2е Mg+2 4 окисление

Слайд 54 ПРОВЕРЯЕМ4H2S+6O4 +3 Zn0
3 Zn+2SO4 + 4H2O + S0Ок-ль S+6 +6е
S0 1 восстановл. 6В-ль Zn0 – 2е Zn+2 3 окисление

Слайд 55 ПРОВЕРЯЕМ2H2S+6O4 + Cu0
Cu+2SO4 + S+4O2 + 2H2OВ-ль Cu0 – 2е
Сu+2 1 окисление 2о-ль S+6 + 2е S0 1 восстановл.

Слайд 56 Домашнее заданиеПрочитать текст учебника на
стр.101-104В рабочей тетради закончить упражнения (кроме упражнения на производство серной кислоты).К следующему уроку подготовить рассказ о свойствах разбавленной и концентрированной серной кислот.


![[24-25.04.2023] пригласительный школьный этап всош по химии 2023-2024 для 9 класса](http://shpora-start.ru/wp-content/uploads/a/b/9/ab984e377f078d955537082a184bb094.jpeg)




























