Схема распределения электронов в атомах галогенов
FOR-DLE.ru — Всё для твоего DLE Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх. Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект. Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте? Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Упражнение 1 Начертите схемы распределения электронов по энергетическим уровням в атомах галогенов.
| F +9 ) ) 2 7 |
|
|
|
Поясните, какой из галогенов и почему должен быть самым сильным окислителем. Самым сильным окислителем среди галогенов является фтор, т.к. его электронная оболочка содержит наименьшее количество электронных слоёв, поэтому у него наименьший радиус атома, следовательно, ему легче присоединить электроны, чем отдать их, по сравнению с другими галогенами.
Упражнение 2 Изобразите строение молекул фтора и фтороводорода с помощью структурных и электронных формул. Укажите вид химической связи в молекулах этих веществ.
| .. ..F―F, :F:F: .. .. | H―F, Н:F |
| Ковалентная неполярная связь | Ковалентная полярная связь |
Упражнение 3 Чем различаются вещества фтор, фтороводород, фторид натрия: а) по виду химической связи; Фтор F2 имеет ковалентную неполярную связь, фтороводород HF ― ковалентную полярную связь, а фторид натрия NaF ― ионную связь. б) по строению кристаллической решётки; Фтор F2 и фтороводород HF имеют металлическую кристаллическую решётку, а фторид натрия NaF ― ионную кристаллическую решётку . в) по химическим свойствам? Простое вещество фтор F2 является сильным окислителем, фтороводород HF ― газообразное вещество, а фторид натрия NaF ― соль.
Упражнение 5 К водному раствору иодида калия добавили раствор крахмального клейстера. Затем через этот раствор пропустили хлор. Как изменился цвет раствора и почему? При добавлении раствора крахмального клейстера к раствору иодиду калия цвет раствора не изменился. В результате пропускания хлора сквозь раствор иодида калия, хлор вытесняет иод из иодида калия: 2KI + Cl2 = 2KCl + I2Иод взаимодействует с крахмалом с образованием соединения синего цвета, поэтому раствор становится синим.
ТЕСТ 1 Наиболее сильным окислителем является галоген 1) фтор 2) хлор 3) бром 4) иод Ответ 1) В ряде галогенов F2, Cl2, Br2, I2 от фтора к иоду уменьшается электроотрицательность галогенов и, следовательно, их окислительная способность.
ТЕСТ 2 Нельзя практически осуществить химическую реакцию 1) KI + Br2 ⟶ 2) KI + Cl2 ⟶ 3) KCl + Br2 ⟶ 4) F2 + H2O ⟶ Ответ: 3 ) В ряде галогенов F2, Cl2, Br2, I2 каждый предыдущий галоген вытесняет последующий из его растворов кислот и солей, поэтому бром не cможет вытеснить хлор с раствора его соли.
Задания
§1. Окислительно-восстановительные реакции
1
2
3
4
5
6
Тестовые задания
§2. Тепловые эффекты химических реакций
2
3
4
§3. Скорость химических реакций
1
2
3
4
Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии
2
3
Тестовые задания
§6. Сущность процесса электролитической диссоциации
1
2
3
4
§7. Диссоциация кислот, оснований и солей
1
2
3
Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации
1
2
3
4
Тестовые задания
§9. Реакции ионного обмена
1
2
3
4
5
6
Тестовые задания
Лабораторный опыт
§10. Гидролиз солей
1
2
3
Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Практическая работа 2
§12. Характеристика галогенов
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§13. Хлор
1
2
3
4
5
6
7
Тестовые задания
§14. Хлороводород: получение и свойства
1
2
3
§15. Соляная кислота и её соли
1
2
3
4
Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств
Практическая работа 3
§17. Характеристика кислорода и серы
1
2
3
4
Тестовые задания
Лабораторный опыт
§18. Свойства и применение серы
1
2
3
Тестовые задания
§19. Сероводород. Сульфиды
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота
1
2
4
Тестовые задания
Лабораторный опыт
§21. Оксид серы(VI). Серная кислота
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота
1
2
3
§24. Аммиак
1
2
3
Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств
Практическая работа 5
§26. Соли аммония
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§27. Азотная кислота
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты
1
2
3
§29. Фосфор
1
2
3
4
Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли
1
2
3
4
§31. Характеристика углерода и кремния. Аллотропия углерода
1
2
3
§32. Химические свойства углерода. Адсорбция
1
2
3
4
5
6
7
Тестовые задания
§33. Оксид углерода(II) — угарный газ
1
2
3
Тестовые задания
§34. Оксид углерода(IV) — углекислый газ
1
2
3
4
Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе
1
2
3
4
5
6
7
Тестовые задания
Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Практическая работа 6
§37. Кремний. Оксид кремния(IV)
1
2
3
Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент
1
2
3
4
§39. Характеристика металлов
1
2
3
4
5
6
Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения
1
2
3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов
1
2
3
Лабораторный опыт
§42. Сплавы
1
2
3
§43. Щелочные металлы
1
2
3
4
5
6
Тестовые задания
§44. Магний. Щелочноземельные металлы
1
2
3
4
5
Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий
1
2
3
4
5
6
7
8
Тестовые задания
§47. Важнейшие соединения алюминия
1
2
3
4
5
Лабораторный опыт
§48. Железо
1
2
3
4
Тестовые задания
§49. Соединения железа
1
2
3
4
Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»
Практическая работа 7
§51. Органическая химия
1
2
3
4
5
6
Тестовые задания
§52. Предельные (насыщенные) углеводороды
1
2
3
4
Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды
1
2
3
4
5
§54. Полимеры
1
2
§55. Производные углеводородов. Спирты
1
2
3
Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры
1
2
3
4
5
6
Тестовые задания
§57. Углеводы
1
2
3
§58. Аминокислоты. Белки
1
2
3
4
5
§12. Характеристика галогенов
Задание 1. Начертите схемы распределения электронов по энергетическим уровням в атомах галогенов. Поясните, какой из галогенов и почему должен быть самым сильным окислителем.
Задание 2. Изобразите строение молекул фтора и фтороводорода с помощью структурных и электронных формул. Укажите вид химической связи в молекулах этих веществ.
Задание 3. Чем различаются вещества фтор, фтороводород, фторид натрия: а) по виду химической связи; б) по строению кристаллической решетки; в) по химическим свойствам.
Задание 4. Охарактеризуйте способы получения галогенов. Какие из галогенов труднее, а какие легче выделить в свободном состоянии?
Задание 5. К водному раствору иодида калия добавили раствор крахмального клейстера. Затем через этот раствор пропустили хлор. Как изменился цвет раствора и почему?
Тестовые задания
1. Наиболее окислителем является галоген: 1) фтор 2) хлор 3) бром 4) йод
Соляная кислота
Водородное соединение хлора — хлороводород — газ с резким запахом, хорошо растворимый в воде. Газ «хлороводород» не проявляет свойств кислоты, например не реагирует с металлами и твёрдыми щелочами. Раствор хлороводорода в воде называется «соляная кислота» и проявляет все свойства сильной кислоты.
Задание 16.6. Составьте уравнения реакций, которые характерны для сильной кислоты.
Поэтому соляная кислота реагирует с металлами, основными оксидами, основаниями, солями слабых кислот, образуя соли хлориды:
Задание 16.7. Закончить эти уравнения реакций.
В реакции с металлами HCl проявляет свойства окислителя, поскольку в процессе окисления участвует атом водорода в высшей степени окисления:
Вопрос. Какие свойства будет проявлять атом хлора, входящий в состав соляной кислоты в окислительно-восстановительных реакциях?
Соляная кислота HCl проявляет свойства восстановителя, если в реакции участвует атом хлора, так как этот атом находится в низшей степени окисления. Это свойство используется для получения хлора в лаборатории:
![]()
Сам хлороводород получается в больших количествах из газообразных простых веществ:
или в лабораторных условиях — действием концентрированной серной кислоты на сухую поваренную соль NaСl:
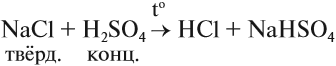
В данном случае при минимальном содержании влаги в смеси хлороводород выделяется в виде газа, и поэтому эта реакция возможна.
Задание 16.8. Составьте ионно-молекулярное уравнение аналогичной реакции, происходящей в растворе, и установите, возможна ли она.
В растворе реакция невозможна, поскольку все вещества — сильные и растворимые электролиты.
Качественной реакцией на хлорид-анион является взаимодействие растворов хлоридов, соляной кислоты с нитратом серебра:
![]()
Выпадает белый творожистый осадок AgCl.
Задание 16.9. Составьте краткое ионно-молекулярное уравнение этой реакции и убедитесь, что в ней участвуют ионы хлора.
Соляная кислота применяется для получения различных солей, для удаления накипи, оксидов и других отложений на различных поверхностях. Хлор и хлороводород широко применяются при синтезе органических соединений (см. следующий раздел).

Строение атома и свойства галогенов
Галогены — общее название химических элементов, которые образуют главную подгруппу седьмой группы.
Задание 16.1. Назовите эти химические элементы.
Вопрос. Что общего в строении атомов этих элементов?
Атомы галогенов — F, Cl, Вr, I, At — имеют на внешнем уровне семь электронов:
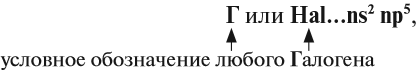
где n — номер внешнего энергетического уровня (совпадает по величине с номером периода, в котором находится химический элемент), поэтому типичным процессом для всех галогенов в химических реакциях будет приём недостающих электронов до восьми (в данном случае одного электрона):
![]()
Таким образом, для этих атомов характерны свойства окислителей, и они легко реагируют с металлами (восстановителями), образуя соли:
Собственно, отсюда и возникло название «галоген»: «галос» — соль, «генес» — рождаю; галогены — образующие соли.
Вопрос. Чем различаются галогены по строению атомов?
Сравнив строение атомов любых двух галогенов:
![]()
легко видеть, что чем ниже в Периодической системе Менделеева находится данный галоген, тем дальше от ядра находятся его валентные электроны.
Вопрос. Влияет ли это на активность галогена как неметалла?
Поэтому сверху вниз (от фтора к астату) способность принимать электроны уменьшается, а значит, уменьшается окислительная и неметаллическая активность. В результате более активные галогены могут вытеснять менее активные галогены из их солей:
В таких реакциях атом галогена, входящий в состав соли, должен иметь низшую степень окисления –1.
Молекулы простых веществ-галогенов двухатомны. С увеличением их молярной массы увеличиваются температуры кипения и плавления этих веществ. Поэтому:
- F2 и Сl2 — газы;
- Br2 — бурая жидкость;
- I2 — тёмно-фиолетовые кристаллы, которые легко испаряются, если йод находится в открытой посуде.
Являясь сильными окислителями, все галогены сильно ядовиты. Но в виде соединений некоторые из них полезны. Например, простое вещество бром Br2 — ядовито, а соединения брома (бромиды) успокаивают. Именно их выписывают врачи, чтобы успокоить человека, уменьшить приступ кашля.
Рассмотрим некоторые свойства галогенов на примере хлора.
Задание 16.2. Изобразите строение атома хлора, определите его высшую и низшую степени окисления.
Все галогены, кроме фтора, могут проявлять в соединениях и отрицательные, и положительные степени окисления:
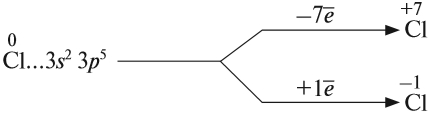
Задание 16.3. Составьте формулы соединений хлора, в которых атом хлора имеет эти степени окисления.
Простое вещество хлор — газ жёлто-зелёного цвета. Очень ядовит. Как и у других галогенов, молекула хлора двухатомна: Cl2. Являясь типичным и очень активным неметаллом, хлор может и принимать, и отдавать электроны, т. е. быть и окислителем, и восстановителем. Но окислительные свойства преобладают. Хлор реагирует с различными металлами и неметаллами:
![]()
Задание 16.4. Определите, какие свойства проявляют атомы хлора в этих окислительно-восстановительных реакциях.
Раствор хлора в воде — хлорная вода — содержит слабую хлорноватистую кислоту НClO, которая довольно быстро разлагается, образуя атомарный кислород:
Хлорноватистая кислота и атомарный кислород — сильнейшие окислители, они разрушают красители, убивают микроорганизмы. Поэтому раствор хлора в воде используют для отбеливания тканей; при помощи хлора дезинфицируют воду.
Аналогичные процессы происходят при пропускании хлора в раствор щёлочи:
![]()
Обратите внимание. Щёлочь как бы нейтрализует те кислоты, которые получались в водном растворе в ходе реакции (1)
Если эта же реакция идёт при нагревании, то состав продуктов реакции изменяется:
![]()
Полученная соль — хлорат калия (Бертолетова соль) — является сильным окислителем. Так, она окисляет фосфор даже при слабом трении:
Эта реакция происходит всякий раз, когда вы чиркаете спичкой (в состав спичечной «головки» входит Бертолетова соль) о спичечный коробок (в его намазку входит фосфор).
Задание 16.5. Расставьте коэффициенты в последних двух уравнениях реакций методом электронного баланса. (В случае затруднений см. урок 7.)
Бертолетова соль входит в состав пиротехнических составов, например бенгальских огней.





























