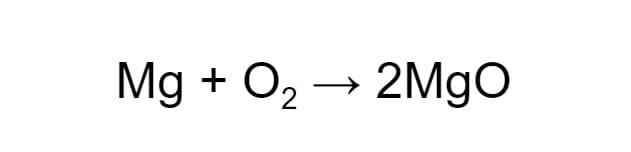Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:

Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
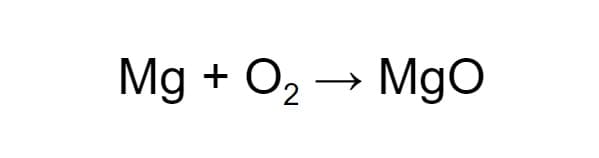
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
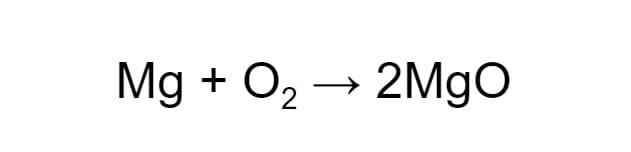
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
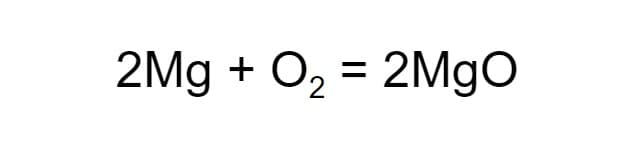
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
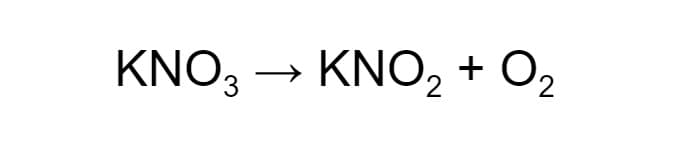
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
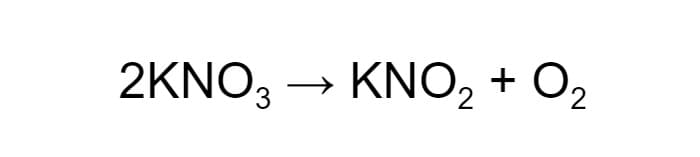
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
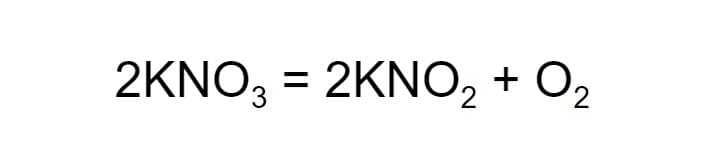
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Похожие ГДЗ Химия 9 класс
Решебник №2
Предыдущее
Следующее
Легче освоить сложный материал девятикласснику поможет «ГДЗ по химии 9 класс учебник Габриелян (Просвещение)». Решебник дает не только верные ответы на сложные задания, но и помогает понять логику решений, что значительно облегчит анализ аналогичных задач.
Преимущества решебника в изучении химии
Учебный материал в девятом классе нельзя назвать легким. Понимание большинства тем учебника требует очень больших затрат времени. Иногда без посторонней помощи просто невозможно разобраться, особенно если по какой-то причине урок был пропущен или учитель не смог доходчиво объяснить материал. Также у школьника может остро стоять необходимость в более углублённом изучении химии как науки. Во всех перечисленных случаях использование ГДЗ просто незаменимо, так как решебник обеспечивает:
- Возможность самопроверки на всех этапах обучения.
- Повышение успеваемости и получение максимального бала по химии.
- Оперативность в систематизированных данных.
- Консолидацию в одном пособии всех заданий и анализ их решений.
Кроме этого решебник доступен круглосуточно в режиме онлайн.
Описание ГДЗ
Содержание «ГДЗ по химии 9 класс учебник Габриелян О.С., Остроумов И.Г., Сладков С.А. (Просвещение)» полностью соответствует всем разделам учебника и включает в себя:
- ответы на вопросы ко всем параграфам;
- подробное описание выполнения лабораторных работ, которые включены в программу девятого класса;
- каждое решение содержит необходимые дополнительные справочные данные.
Информация решебника имеет удобный для восприятия формат и значительно упростит школьникам как выполнение домашнего задания, так и подготовку к различным видам оценивания знаний.
Способ получения
1. Хлорид магния можно получить путем взаимодействия магния и разбавленной хлороводородной кислоты, образуются хлорид магния и газ водород
2. При комнатной температуре, в результате взаимодействия магния и влажного хлора, образуется хлорид магния
3. Разбавленная хлороводородная кислота реагирует с гидроксидом магния . Взаимодействие хлороводородной кислоты с гидроксидом магния приводит к образованию хлорида магния и воды:
4. Карбонат лития взаимодействует с разбавленной соляной кислотой , образуя хлорид магния, углекислый газ и воду:
5. Оксид магния взаимодействует с разбавленной соляной кислотой , образуя хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
6. В результате взаимодействия оксида магния , углерода и хлора при 800 — 1000º С образуется хлорид магния и угарный газ:
MgO + C + Cl2 = MgCl2 + CO
Что узнали. Чему научились
Номер 1.
Объясни приём вычисления.
18 ∙ 20 = 18 ∙ (2 ∙ 10) = (18 ∙ 2) ∙ 10 = 36 ∙ 10 = 360
25 ∙ 12 = 25 ∙ (4 ∙ 3) = (25 ∙ 4) ∙ 3 = 100 ∙ 3 = 300
Ответ:
Перестановка и группировка множителей.
Номер 2.
Закончи решение.
Ответ:
1) 35 ∙ 20 = 35 ∙ (2 ∙ 10) = (35 ∙ 2) ∙ 10 = 700
25 ∙ 24 = 25 ∙ (4 ∙ 6) = (25 ∙ 4) ∙ 6 = 600
2) 16 ∙ 30 = 16 ∙ (3 ∙ 10) = (16 ∙ 3) ∙ 10 = 480
42 ∙ 20 = 42 ∙ (2 ∙ 10) = (42 ∙ 2) ∙ 10 = 840
12 ∙ 40 = 12 ∙ (4 ∙ 10) = ( 12 ∙ 4) ∙ 10 = 480
25 ∙ 16 = 5 ∙ 5 ∙ 2 ∙ 8 = (5 ∙ 2) ∙ (5 ∙ ![]() = 10 ∙ 40 = 400
= 10 ∙ 40 = 400
15 ∙ 18 = 3 ∙ 5 ∙ 2 ∙ 9 = (5 ∙ 2) ∙ (3 ∙ 9) = 10 ∙ 27 = 270
45 ∙ 14 = 9 ∙ 5 ∙ 2 ∙ 7 = (5 ∙ 2) ∙ (9 ∙ 7) = 10 ∙ 63 = 630
13 ∙ 60 = 13 ∙ (6 ∙ 10) = (13 ∙ 6) ∙ 10 = 780
45 ∙ 20 = 45 ∙ (2 ∙ 10) = (45 ∙ 2) ∙ 10 = 900
15 ∙ 30 = 15 ∙ (3 ∙ 10) = (15 ∙ 3) ∙ 10 = 450
14 ∙ 50 = 2 ∙ 7 ∙ 5 ∙ 10 = (2 ∙ 5) ∙ (7 ∙ 10) = 700
Номер 3.
Сравни выражения и поставь знак >, < или =, чтобы получились верные записи.
Ответ:
18 ∙ 40 = 18 ∙ 4 ∙ 10
18 ∙ 40 = 18 ∙ 40
72 ∙ 14 < 72 ∙ 10 ∙ 4
72 ∙ 14 < 72 ∙ 40
36 ∙ 5 ∙ 10 > 36 ∙ 15
36 ∙ 50 > 36 ∙ 15
98 ∙ 21 = 98 ∙ 3 ∙ 7
98 ∙ 21 = 98 ∙ 21
Номер 4.
Для ремонта квартиры купили 8 рулонов обоев длиной по 10 м 50 см. После ремонта осталась одна четвёртая часть купленных обоев. Сколько метров обоев осталось? Реши задачу разными способами.
Ответ:
Можно оформить в виде чертежа:
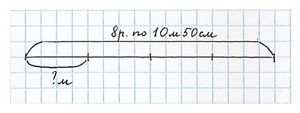
Способ решения 1:
Способ решения 2:
1) 10 м 50 см ∙ 8 = 84 (м) – было куплено обоев.
2) 84 : 4 = 21 (м) – обоев осталось.
1) 8 : 4 = 2 (р.) – обоев осталось после ремонта.
2) 10 м 50 см ∙ 2 = 21 (м) – обоев осталось после ремонта.
Ответ: 21 м.
Номер 5.
Школьная библиотека получила 290 новых учебников в одинаковых пачках. Учебников по русскому языку было 10 пачек, столько же пачек учебников по чтению и 9 пачек учебников по математике. Объясни, что показывают выражения.
Ответ:
290 : (10 + 10 + 9) = 10 – количество учебников в одной пачке.
290 : (10 + 10 + 9) ∙ 9 = 90 – количество учебников по математике.
Номер 6.
Ответ:
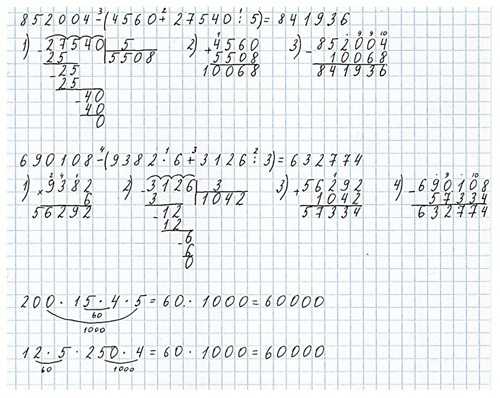
Номер 7.
Рассмотри таблицу и объясни, что обозначают выражения.
1) 30 : 5; 2) 400 : 100; 3) 100 : 5; 4) 100 − 5; 5) 30 : 5 + 400 : 100; 6) 30 : 5 − 400 : 100.
 Ответ:
Ответ:
1) Время движения первого объекта.
2) Время движения второго объекта.
3) Во сколько раз скорость второго объекта больше скорости первого.
4) На сколько км/ч скорость второго объекта больше скорости первого.
5) Общее время движения обоих объектов.
6) На сколько больше был в движении первый объект, чем второй.
Номер 8.
Выполни деление с остатком и проверку.
Ответ:
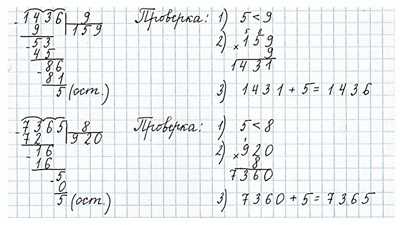

Номер 9.
Ответ:

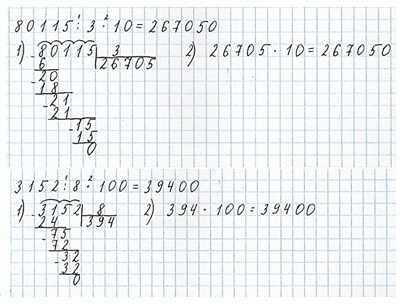
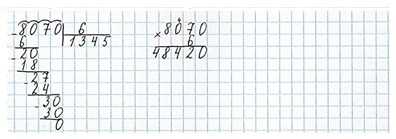
Задания на полях страницы
Ребус.
Ответ:
Реши. Найди лишнее уравнение.
Ответ:
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH4OH);
- сильные кислоты (H2SO4, HNO3, HCl, HBr, HI, HClO4, HClO3, H2SeO4, …).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH4OH и сходные с ним вещества);
- все слабые кислоты (H2СO3, HNO2, H2S, H2SiO3, HCN, HClO, практически все органические кислоты …);
- вообще, все слабые электролиты (включая воду!!!);
- оксиды (всех типов);
- все газообразные соединения (в частности, H2, CO2, SO2, H2S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1
Из принципиально важного в списке N 2 еще раз отмечу воду
Пример 2. Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение. Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH)2 + 2H+ + 2Cl- = Cu2++ 2Cl- + 2H2O.
Пример 3. Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение. Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO2 + 2NaOH = Na2CO3 + H2O.
CO2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na2CO3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO2 + 2Na+ + 2OH- = Na2++ CO32- + H2O.
Пример 4. Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение. Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na2S + ZnCl2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na+ + S2- + Zn2+ + 2Cl- = ZnS↓ + 2Na+ + 2Cl-.
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4. Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO3 =
- H2SO4 + MgO =
- Ca(NO3)2 + Na3PO4 =
- CoBr2 + Ca(OH)2 =
Упражнение 5. Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Уравнения реакций получения хлорида магния четырьмя способами
Вопрос по химии:
Напишите не менее четырёх-пяти уравнений реакций получения хлорида магния. Там, где это имеет место, запишите и ионные уравнения и рассмотрите окислительно-восстановительные процессы. Пожалуйста помогите НУЖНО СРОЧНО.
Ответы и объяснения 2
1. Mg + Cl2 —> MgCl2 Mg(0) -2e- —> Mg(2+) Cl2 + 2e- —> MgCl2
2. Mg(OH)2 + 2HCl—> MgCl2 + 2H2O Mg(OH)2 + 2H(+)—> Mg(2+) + 2H2O
3. MgO + 2HCl —> MgCl2 + H2O MgO + 2H(+)—> Mg(2+) + H2O
4. MgSO4 + BaCl2 —> BaSO4 (осадок) + MgCl2 (в растворе) Ba(2+) + SO4(2-) —> BaSO4
1) Mg + Cl2 = MgCl2
0 +2Mg -2e- = Mg 2 1 в-ль, ок-е
0 — 2Cl2 + 2e=2 Cl 2 1 ок-ль, в-е
3) Mg(OH)2 + 2HCl= MgCl2 + 2H2O
+ — +2 —Mg(OH)2 + 2H+2Cl= Mg+2Cl+2H2O
4) Mg+2HCl=MgCl2 + H2
Mg-2e= Mg 2 1 в-ль, ок-е
2H +2e=H2 2 1 ок-ль, в-е
5) MgCO3+2HCl= MgCl2+ CO2+H2O
+2 -2 + — +2 —Mg+CO3+2H+2Cl= Mg+2Cl+ CO2+H2O
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
Странички для любознательных
Номер 1.
Витя ждал гостей на день рождения. Вокруг стола поставили несколько табуретов и несколько стульев. У каждого табурета было по 3 ножки, а у каждого стула – по 4. Ребята заняли все стулья и табуреты, и оказалось, что всех ножек – у стульев, табуретов и ребят – 49. Сколько всего ребят было за столом?
Ответ:
9 детей, 5 табуретов, 4 стула.
5 ∙ 3 = 15
4 ∙ 4 = 16
9 ∙ 2 = 18
15 + 16 + 18 = 49
Номер 2.
Крепость окружена стеной, имеющей форму квадрата. На каждой стороне есть ворота, у которых всегда стоят 2 солдата. Начальнику караула нужно усилить охрану так, чтобы у каждой стены было не 2 солдата, а 3, но чтобы общее их число не изменилось. Начальник караула справился с задачей. Попытайся и ты (рис. 1).
Ответ:
Оставляем одного солдата у ворот, а остальных расставляем по углам.
Номер 3.
3. Какое число обозначает каждая буква в квадрате (рис. 2), если известно, что:
1) А в 2 раза меньше, чем С;
2) С равно сумме К и D;
3) К равно разности D и В;
4) D в 3 раза больше, чем В;
5) В в 4 раза меньше, чем 944?
Проверь: сумма всех чисел равна 3186.
Ответ:
1) В = 944 : 4 = 236;
2) D = 236 ∙ 3 = 708;
3) K = 708 − 236 = 472;
4) C = 472 + 708 = 1180;
5) A = 1180 : 2 = 590.
Проверка: 236 + 708 + 472 + 1180 + 590 = 3186.