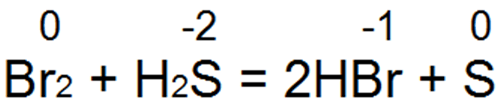Сера цвет
Несмотря на высокую химическую активность, сера довольно широко встречается в виде минерала, который называется самородной серой. Это почти исключительно ромбическая сера. Прочие аллотропные видоизменения серы в природе не встречаются, химически чистая сера имеет лимонно-желтый цвет, аналогично такую же окраску имеет вулканическая серо, но при условии, что в ее состав не входят другие или ().
Сера обычно вкраплена в различные горные породы, из которых довольно легко может быть выплавлена. чаще всего имеет вулканическое происхождение. Богаты Самородной серой Кавказ, пустыня Кара-Кум, Керченский полуостров, Узбекистан.
Сера встречается также в виде сернистых металлов «г-сульфидов ( FeS2, цинковая обманка ZnS, свинцовый блеск PbS), в виде сульфатов (глауберова соль Na2SO4 · 10H2O, CaSО4·2H2О). Сера входит в состав некоторых белков. Для того чтобы извлечь серу из породы, ее выплавляют в автоклавах Действием перегретого водяного пара при 150-160°. Полученную расплавленную серу рафинируют (очищают) возгонкой. Если ее расплавить и разлить по деревянным формочкам, то она затвердевает в виде палочек. Такую серу называют черенковой.
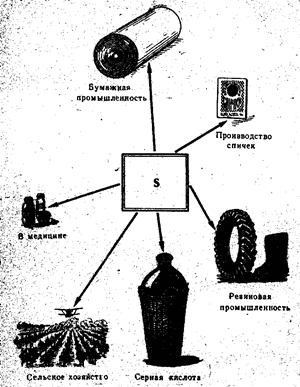
Рис. 52. Применение серы
Иногда серу выливают в большую форму, а после затвердевания раскалывают на мелкие бесформенные куски. Такая сера называется комовой. Наконец, серу можно получить в виде мелкого распыленного порошка — так называемого серного цвета.
Свободная сера применяется главным образом в производстве серной кислоты, а также в бумажной промышленности, для вулканизации каучука, в производстве красителей, в сельском хозяйстве для опыления и окуривания винограда и хлопчатника, в производстве спичек (рис. 52). В медицине сера используется в виде мазей вместе с другими веществами против чесотки и других кожных заболеваний. Чистая сера не ядовита.
■ 73. Перечислите химические свойства серы я укажите, в чём сходство и в чем различие серы и кислорода.
Аллотропия химических элементов (4 часть):
| 91 | Протактиний | Pa | 2 аллотропные модификации протактиния:
— протактиний с тетрагональной кристаллической решёткой, — протактиний с кубической объёмно-центрированной кристаллической решёткой |
| 92 | Уран | U | 3 аллотропные модификации урана:
— α-уран с орторомбической кристаллической решёткой, — β-уран с тетрагональной кристаллической решёткой, — γ-уран с кубической объёмно-центрированной кристаллической решёткой |
| 93 | Нептуний | Np | 3 аллотропные модификации нептуния:
— α-нептуний с орторомбической кристаллической решёткой, — β-нептуний с тетрагональной плотноупакованной кристаллической решёткой, — γ-нептуний с кубической объёмно-центрированной кристаллической решёткой |
| 94 | Плутоний | Pu | 7 аллотропных модификаций плутония:
— α-плутоний, — β-плутоний, — γ-плутоний, — δ-плутоний, — δ’-плутоний, — ε-плутоний, — ζ-плутоний |
| 95 | Америций | Am | 2 аллотропные модификации америция:
— α-америций с двойной гексагональной плотноупакованной кристаллической решёткой, — β-америций с кубической гранецентрированной кристаллической решёткой |
| 96 | Кюрий | Cm | 3 аллотропные модификации кюрия:
— α-кюрий с двойной гексагональной плотноупакованной кристаллической решёткой, — β-кюрий с кубической гранецентрированной кристаллической решёткой, — γ-кюрий с орторомбической кристаллической решёткой |
| 97 | Берклий | Bk | 4 аллотропные модификации берклия:
— α-берклий с двойной гексагональной плотноупакованной кристаллической решёткой, — β-берклий с кубической гранецентрированной кристаллической решёткой, — γ-берклий с орторомбической кристаллической решёткой, — берклий с кубической гранецентрированной кристаллической решёткой, схожей с кристаллической решёткой β-берклия |
| 98 | Калифорний | Cf | 3 аллотропные модификации калифорния:
— α-калифорний с двойной гексагональной плотноупакованной кристаллической решёткой, — β-калифорний с кубической гранецентрированной кристаллической решёткой, — γ-калифорний с орторомбической кристаллической решёткой |
| 99 | Эйнштейний | Es | |
| 100 | Фермий | Fm | |
| 101 | Менделевий | Md | |
| 102 | Нобелий | No | |
| 103 | Лоуренсий | Lr | |
| 104 | Резерфордий (Курчатовий) | Rf | |
| 105 | Дубний (Нильсборий) | Db | |
| 106 | Сиборгий | Sg | |
| 107 | Борий | Bh | |
| 108 | Хассий | Hs | |
| 109 | Мейтнерий | Mt | |
| 110 | Дармштадтий | Ds |
Ответы на вопрос
Отвечает Скрябина Елизавета.
Конечно, давайте подробно рассмотрим образование химических связей в соединениях ZnO, CO₂, H₂ и Al.
-
ZnO (Оксид цинка):
- Атомы: Один атом цинка (Zn) и один атом кислорода (O).
- Тип связи: Ионная связь.
- Как образуется: Атом цинка (Zn), имеющий два электрона на внешней оболочке, отдает их атому кислорода (O), который имеет шесть валентных электронов. Кислород принимает эти два электрона, дополняя свою внешнюю оболочку до восьми электронов, что делает его стабильным. В результате образуется ионная связь, где Zn становится положительным ионом (Zn²⁺), а O — отрицательным ионом (O²⁻).
-
CO₂ (Диоксид углерода):
- Атомы: Один атом углерода (C) и два атома кислорода (O).
- Тип связи: Ковалентная полярная связь.
- Как образуется: Атом углерода образует две двойные связи с двумя атомами кислорода. Углерод делит свои четыре валентных электрона с двумя атомами кислорода, при этом каждый атом кислорода делится двумя электронами с углеродом. Это приводит к образованию двух двойных связей, что обеспечивает стабильность молекулы CO₂.
-
H₂ (Водород):
- Атомы: Два атома водорода (H).
- Тип связи: Ковалентная неполярная связь.
- Как образуется: Два атома водорода делят свои валентные электроны, образуя одинарную связь. Каждый атом водорода имеет один валентный электрон, и когда они объединяются, они делит эти электроны, образуя стабильную молекулу H₂ с полной внешней оболочкой.
-
Al (Алюминий):
- Атомы: Алюминий — элементарное вещество, состоящее из одиночных атомов Al.
- Тип связи: Металлическая связь.
- Как образуется: В чистом металлическом алюминии атомы Al упакованы в плотную кристаллическую решетку. Каждый атом Al отдает свои валентные электроны, образуя «море» свободно движущихся электронов. Эти свободные электроны держатся вокруг положительных атомных ядер алюминия, обеспечивая прочность и проводимость металла.
Каждое из этих соединений демонстрирует разные типы химических связей, отражающих уникальные свойства элементов, их электронные конфигурации и способы взаимодействия для достижения стабильности.
Строение
Сера – 16 элемент периодической таблицы, находящийся в VI группе, главной подгруппе и в третьем периоде. Формула серы – S. Относительная атомная масса – 32.
Ядро атома серы имеет положительный заряд +16. Вокруг ядра располагается 16 отрицательно заряженных электронов на трёх энергетических уровнях.
Электронное строение атома серы – 1s22s22p63s23p4. На внешнем энергетическом уровне находится шесть валентных электронов. До завершения р-орбитали не хватает двух электронов, поэтому степень окисления серы -2.
Рис. 1. Строение атома серы.
Известно четыре стабильных изотопа серы, находящиеся в природе. Это 32S, 33S, 34S, 36S. Кроме того, искусственно получено 20 радиоактивных изотопов серы.
Свойства
В зависимости от реакции сера проявляет разную степень окисления:
- -2 – в реакциях с металлами и неметаллами (Al2S3, SiS2, Na2S);
- +4 – в реакциях с галогенами и кислородом (SCl4, SBr4, SF4, SO2);
- +6 – в реакциях с элементами, имеющими большую электроотрицательность (H2SO4, SF6, SO3).
Сера – активное вещество, образующее кислоты, соли, оксиды. Общие химические свойства элемента приведены в таблице.
|
Реакция |
Описание |
Уравнение |
|
С металлами |
В обычных условиях реагирует только с активными металлами. С остальными реакция протекает при нагревании. С золотом и платиной не реагирует. Образуются сульфиды |
– 2Na + S → Na2S; – Cu + S → CuS; – Zn + S → ZnS |
|
С неметаллами |
С водородом реагирует при 150-200°С, с кислородом – при 280-360°С. С фосфором и углеродом реагирует в отсутствии воздуха при нагревании. Реакция с фтором протекает в присутствии катализатора |
– H2 + S → H2S; – S + O2 → SO2; – 2S + 3O2 → 2SO3; – 2P + 3S → P2S3; – 2S + C → CS2; – S + 3F2 → SF6 |
|
С кислотами |
Проявляет свойства восстановителя |
S + 2HNO3 → 2NO + H2SO4 |
|
Диспропорционирование |
Реакция со щёлочью образует сульфиды и сульфиты |
3S + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O |
В природе сера находится в составе минералов, горных пород, полезных ископаемых. Например, в составе гипса (CaSO4⋅2H2O), пирита (FeS2), глауберовой соли (Na2SO4⋅10H2O). Серу как продукт метаболизма вырабатывают некоторые бактерии. Сера присутствует в составе белков.
Рис. 3. Самородная сера.
Что мы узнали?
Из урока химии 9 класса узнали об особенностях строения и свойствах серы. Это 16 элемент периодической таблицы, содержащий шесть валентных электронов. Сера проявляет три степени окисления – +4, +6, -2. Элемент образует три модификации – ромбическую, моноклинную, пластическую серу. Реагирует с металлами, неметаллами, кислотами и щелочами. Соли серы с металлами называются сульфидами. Сера входит в состав живых организмов. В природе находится в составе минералов.
-
/10
Вопрос 1 из 10
Последние заданные вопросы в категории Химия
Химия 09.01.2024 01:03 391 Юдаева Ульяна
Запишите диссоциацию веществ: NaOH, BaSO4, H3PO4, CuSO4, Fe(OH)3, ZnCl2, Ba(OH)2, Na2SO3, ZnSiO3,
Ответов: 1
Химия 08.01.2024 20:37 281 Сергеев Никита
Краткому ионному уравнению 2H++S2-=H2S соответсвует взаимодействие между
Ответов: 1
Химия 08.01.2024 20:25 405 Пряничников Александр
Насыпал на блюдце немного соды и добавил по каплям столовый уксус Вывод : -? Наблюдение : -?
Ответов: 1
Химия 08.01.2024 18:47 275 Бренюк Паша
1 В предложенном перечне укажите название электролита, при диссоциации которого в качестве катионов
Ответов: 1
Химия 08.01.2024 15:31 182 Белоусова Амалия
Расставить степени окисления у атомов для следующих веществ: 1.MnCI4 2.Cu20. 3.Na2S 4.NaOH
Ответов: 1
Химия 08.01.2024 14:21 209 Дорошина Елена
Выберите пары, вещества в которых могут реагировать с образованием хлороводорода. H2 и Cl2 H2S и
Ответов: 1
Химия 08.01.2024 11:36 188 Шалимова Машуля
нужно рассчитать массу 2 моль газа водорода и число молекул в этом количестве вещества. с \»дано\»
Ответов: 1
Химия 08.01.2024 11:20 213 Кошля Аліна
Оксиду кальция массой 28 г соответствует количество вещества: 1) 1 моль 2) 0, 1 моль 32 моль 4105
Ответов: 1
Химия 08.01.2024 09:36 180 Булихова Анастасия
1. Какова масса 3,01×1023 атомов железа? 2. Какова масса 0,2 моль серной кислоты H2SO4? 3. Какое
Ответов: 1
Химия 08.01.2024 09:43 122 Кирьянова Юлия
Определите валентность элемента, стоящего на первом месте в формуле газа, который выделяется в
Ответов: 1
Аллотропия химических элементов (3 часть):
| 61 | Прометий | Pm | 2 аллотропные модификации прометия:
— α-прометий с двойной гексагональной плотноупакованной кристаллической решёткой, — β-прометий с кубической объёмноцентрированной кристаллической решёткой |
| 62* | Самарий * | Sm | Несколько аллотропных модификаций самария, в т.ч.:
— α-самарий с ромбоэдрической (тригональной) кристаллической решёткой, — самарий с гексагональной плотноупакованной кристаллической решёткой, — β-самарий с кубической объёмно-центрированной кристаллической решёткой |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | 2 аллотропные модификации гадолиния:
— α-гадолиний с гексагональной плотноупакованной кристаллической решёткой, — β-гадолиний с кубической объёмно-центрированной кристаллической решёткой |
| 65 | Тербий | Tb | 2 аллотропные модификации тербия:
— α-тербий с гексагональной плотноупакованной кристаллической решёткой, — β-тербий |
| 66 | Диспрозий | Dy | 2 аллотропные модификации диспрозия:
— α-диспрозий с гексагональной плотноупакованной кристаллической решёткой, — β-диспрозий с кубической объёмно-центрированной кристаллической решёткой |
| 67 | Гольмий | Ho | 2 аллотропные модификации гольмия:
— α-гольмий с гексагональной плотноупакованной кристаллической решёткой, — β-гольмий с кубической объёмно-центрированной кристаллической решёткой |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | 2 аллотропные модификации тулия:
— α-тулий с тетрагональной кристаллической решёткой, — β-тулий с гексагональной плотноупакованной кристаллической решёткой |
| 70 | Иттербий | Yb | 3 аллотропные модификации иттербия:
— α-иттербий с гексагональной плотноупакованной кристаллической решёткой, — β-иттербий с кубической гранецентрированной кристаллической решёткой, — γ-иттербий с кубической гранецентрированной кристаллической решёткой |
| 71 | Лютеций | Lu | |
| 72 | Гафний | Hf | 2 аллотропные модификации гафния:
— α-гафний с гексагональной плотноупакованной кристаллической решёткой, — β-гафний кубической объёмно-центрированной кристаллической решёткой |
| 73 | Тантал | Ta | 2 аллотропные модификации тантала:
— α-тантал с кубической объёмно-центрированной кристаллической решёткой, — β-тантал с тетрагональной кристаллической решёткой |
| 74 | Вольфрам | W | 2 аллотропные модификации вольфрама:
— α-вольфрам с кубической объёмно-центрированной кристаллической решёткой, — β-вольфрам с кубической кристаллической решёткой, именуемой фаза А15 |
| 75 | Рений | Re | |
| 76 | Осмий | Os | |
| 77 | Иридий | Ir | |
| 78 | Платина | Pt | |
| 79 | Золото | Au | |
| 80 | Ртуть | Hg | 3 аллотропные модификации ртути:
— α-ртуть, — β-ртуть, — γ-ртуть |
| 81 | Таллий | Tl | 3 аллотропные модификации таллия:
— таллий с гексагональной плотноупакованной кристаллической решёткой, — таллий с кубической объёмно-центрированной кристаллической решёткой, — таллий с кубической гранецентрированной кристаллической решёткой |
| 82 | Свинец | Pb | |
| 83 | Висмут | Bi | 8 аллотропных модификаций висмута |
| 84 | Полоний | Po | 2 аллотропные модификации полония:
— α-полоний, — β-полоний |
| 85 | Астат | At | |
| 86 | Радон | Rn | |
| 87 | Франций | Fr | |
| 88 | Радий | Ra | |
| 89 | Актиний | Ac | |
| 90 | Торий | Th | 3 аллотропные модификации тория:
— α-торий с кубической гранецентрированной кристаллической решёткой, — β-торий с кубической объемно-центрированной кристаллической решёткой, — γ-торий с тетрагональной объемно-центрированной кристаллической решёткой |
Соединения двухвалентной серы
Двухвалентная сера образует соединения с водородом ( H2S) и металлами (сульфиды Na2S, FeS). Сульфиды можно рассматривать как производные сероводорода, т. е. соли сероводородной кислоты.
Сероводород
. Молекула сероводорода построена по полярному типу связи:
Общие электронные пары сильно смещены в сторону атома, серы как более электроотрицательного.
Сероводород-газ тяжелее воздуха, с резким неприятным запахом тухлых яиц. Этот газ очень ядовит. Наши органы обоняния весьма чувствительны к сероводороду. При наличии 1/2000 части сероводорода в воздухе может наступить потеря обоняния. Хроническое отравление сероводородом в малых дозах вызывает исхудание, головные, боли. В случае более сильных отравлений через некоторое время может наступить обморок, а очень сильные концентрации вызывают смерть от паралича дыхания. При отравлениях сероводородом необходимо вынести рольного на свежий воздух и дать ему вдыхать небольшие количества хлора, а также чистый . Предельно допустимая концентрация сероводорода в рабочем помещении 0,01 мг/л.
Сероводород переходит в жидкое состояние при температуре -60°. Он хорошо растворяется в воде, образуя при этом сероводородную воду H2Saq или, как ее еще называют, сероводородную кислоту.
Сероводород — один из лучших восстановителей. Он легко восстанавливает бромную и хлорную воду вбромисто водородную или соляную кислоту:
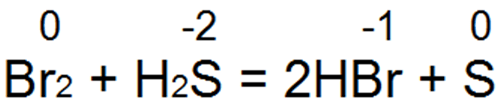
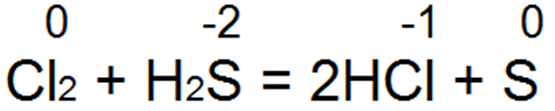
При этой реакции S(-2) окисляется до» нейтральной серы S(0).
Сероводород горит. При достаточном доступе воздуха (рис. 53,а) происходит полное сгорание по уравнению:
В этом случае S(-2) окисляется до S(+4), происходит отдача 6 электронов), а восстанавливается с О(0) до О(-2). Если
доступ воздуха недостаточный или если в пламя сероводорода внести холодный предмет (рис. 53,6), то происходит неполное сгорание по уравнению:
2H2S + О2 = 2S + 2H2O
■ 74. Назовите меры первой помощи при отравлениях сероводородом.
75. Почему сероводородную кислоту часто называют
сероводородной водой?
76. При смешивании йодной воды с сероводородной происходит обесцвечивание и помутнение раствора. Чем это объяснить?
77. Возможно ли для S(-2) проявление окислительных свойств?
В лаборатории сероводород получают в аппарате Киппа при взаимодействии сульфида железа (или сульфида натрия) с разбавленной серной кислотой:
FeS + H2SO4 = FeSО4 + H2S
Рис. 53. Горение сероводорода при полном доступе воздуха (а) и при неполном доступе воздуха (б).
Сероводород, растворяясь в воде, образует слабую сероводородную кислоту, диссоциирующую двухступенчато:
H2S ⇄ Н + + HS — ⇄ 2Н + + S 2-
Вторая ступень протекает в незначительной степени.
Сероводородная кислота не может храниться в лаборатории длительное время вследствие своей неустойчивости. Она постепенно мутнеет в результате выделения свободной серы:
H2S = H2 + S
В окислительно-восстановительных реакциях сероводородная кислота Ведет себя как типичный восстановитель, например:
H2S + К2Cr2O7 + H2SO4 → (S 0 ; Cr +3)
Уравнение этой окислительно-восстановительной реакции закончите самостоятельно.
Сероводород применяется в аналитической химии.
Сероводородная кислота проявляет общие свойства кислот. Правда, не все свойства кислот удается наблюдать на ней. Например, такие , как , с ней не реагируют, а и , попадая в сероводородную, кислоту, реагируют не с ней, а с имеющейся там водой, образуя щелочь, которая затем может вступить в реакцию с сероводородной кислотой.
Так как это кислота двухосновная, она может образовывать два ряда солей — сульфиды и гидросульфиды, или бисульфиды.
Средние соли сероводородной кислоты — сульфиды — нерастворимы в воде, кроме солей натрия и калия, и имеют различную окраску: сульфид свинца и железа — черную, цинка — белую, кадмия — желтую. Гидросульфиды хорошо растворимы в воде.
Реактивом на ион двухвалентной серы S 2- является ион кадмия Cd 2+ , который в соединении с ионом дает желтый, нерастворимый в воде осадок, например:
Cd(NO3)2 + H2S = CdS↓ + 2HNO3
Cd 2+ + S 2- = CdS
Сульфиды довольно легко гидролизуются по типу солей слабых кислот, поэтому обычно их получают прямым взаимодействием серы с металлом.
■ 78. Напишите уравнение реакции сероводородной кислоты с едким натром и объясните результат реакции, учитывая гидролиз соли в растворе.
79. В санитарно-гигиенических исследованиях для обнаружения В воздухе сероводорода пользуются очень чувствительной реакцией с растворимыми солями свинца. Что можно наблюдать при этой реакции в полной ионной и сокращенной ионной формах?
Аллотропия химических элементов (2 часть):
| 31 | Галлий | Ga | Несколько аллотропных модификаций галлия, из которых устойчивым в условиях окружающей среды является α-галлий |
| 32 | Германий | Ge | 2 аллотропные модификации германия:
— α-германий с кубической алмазной кристаллической решёткой, — β-германий с тетрагональной кристаллической решёткой |
| 33 | Мышьяк | As | 3 аллотропные модификации мышьяка:
— α-мышьяк, серый мышьяк (наиболее распространенная, металлическая модификация) с ромбоэдрической (тригональной) кристаллической решёткой, — β-мышьяк, чёрный мышьяк (неметаллическая модификация) в виде: стеклянной аморфной чёрной формы мышьяка или метастабильной орторомбической чёрной формы мышьяка, — γ-мышьяк, жёлтый мышьяк (неметаллическая модификация) |
| 34 | Селен | Se | Несколько аллотропных модификаций селена, в т.ч.:
— γ-селен, серый кристаллический селен, металлический селен (наиболее устойчивая форма) |
| 35 | Бром | Br | |
| 36 | Криптон | Kr | |
| 37 | Рубидий | Rb | |
| 38 | Стронций | Sr | 3 аллотропные модификации стронция:
— α-стронций с кубической гранецентрированной кристаллической решёткой, — β-стронций с гексагональной кристаллической решёткой, — γ-стронций с кубической объёмно-центрированной кристаллической решёткой |
| 39 | Иттрий | Y | 2 аллотропные модификации иттрия:
— α-иттрий с гексагональной плотноупакованной кристаллической решёткой, — β-иттрий кубической объёмно-центрированной кристаллической решёткой |
| 40 | Цирконий | Zr | 3 аллотропные модификации циркония:
— α-цирконий с гексагональной плотноупакованной кристаллической решёткой, — β-цирконий с кубической объёмно-центрированной кристаллической решёткой, — ω-цирконий с гексагональной кристаллической решёткой |
| 41 | Ниобий | Nb | |
| 42 | Молибден | Mo | |
| 43 | Технеций | Tc | |
| 44 | Рутений | Ru | |
| 45 | Родий | Rh | |
| 46 | Палладий | Pd | |
| 47 | Серебро | Ag | |
| 48 | Кадмий | Cd | |
| 49 | Индий | In | |
| 50 | Олово | Sn | 4 аллотропные модификации олова:
— α-олово, серое олово, с кубической алмазной кристаллической решёткой, — β-олово, белое олово, с тетрагональной объёмно-центрированной кристаллической решёткой, — γ-олово, — σ-олово |
| 51 | Сурьма | Sb | Несколько аллотропных модификаций сурьмы, в т.ч.:
— металлическая сурьма (металлическая форма) – наиболее стабильная форма, — взрывчатая сурьма, — чёрная сурьма, — жёлтая сурьма |
| 52 | Теллур | Te | 2 аллотропные модификации теллура:
— α-теллур (кристаллический, металлический теллур) с гексагональной кристаллической решёткой, — аморфный теллур в виде чёрно-коричневого порошка |
| 53 | Йод | I | |
| 54 | Ксенон | Xe | 2 аллотропные модификации ксенона:
— ксенон с кубической гранецентрированной кристаллической решёткой, — ксенон с гексагональной плотноупакованной кристаллической решёткой |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | 2 аллотропные модификации бария:
— α-барий с кубической объёмно-центрированной кристаллической решёткой, — β-барий |
| 57 | Лантан | La | 3 аллотропные модификации лантана:
— α-лантан с двойной гексагональной плотноупакованной кристаллической решёткой, — β-лантан с кубической гранецентрированной кристаллической решёткой, — γ-лантан с кубической объёмно-центрированной кристаллической решёткой |
| 58 | Церий | Ce | 4 аллотропные модификации церия:
— α-церий с кубической гранецентрированной кристаллической решёткой, — β-церий с двойной гексагональной плотноупакованной кристаллической решёткой, — γ-церий с кубической гранецентрированной кристаллической решёткой, — δ-церий с кубической объемно-центрированной кристаллической решёткой |
| 59 | Празеодим | Pr | 2 аллотропные модификации празеодима:
— α-празеодим с двойной гексагональной плотноупакованной кристаллической решёткой, — β-празеодим с кубической объёмноцентрированной кристаллической решёткой |
| 60 | Неодим | Nd | 2 аллотропные модификации неодима:
— α-неодим с двойной гексагональной плотноупакованной кристаллической решёткой, — β-неодим с кубической объемно-центрированной кристаллической решёткой |
Аллотропия
Сера – хрупкое кристаллическое вещество желтоватого цвета. При нагревании плавится, превращаясь в жидкость жёлтого цвета. При увеличении температуры до 200°С становится вязкой тёмно-коричневой массой, напоминающей смолу.
Основные физические свойства элемента:
- отсутствие растворимости в воде, в том числе в составе сложных веществ;
- плавучесть в воде (не смачивается);
- плохая проводимость тепла и электричества;
- хорошая растворимость в органических растворителях (феноле, бензоле, сероуглероде);
- диссоциация на атомы происходит при температуре 1500°С;
- температура кипения – 444,6°С.
Сера образует аллотропные модификации, которые отличаются физическими свойствами. Краткое описание модификаций приведено в таблице.
|
Вид |
Формула |
Температура плавления, °С |
Плотность, г/см3 |
Особенности |
|
Ромбическая |
S8 |
113 |
2,07 |
Наиболее устойчивая модификация |
|
Моноклинная |
S8 |
119 |
1,96 |
Устойчива при температуре 96°С и более. В обычных условиях превращается в ромбическую |
|
Пластическая |
Sn |
119 |
1,96 |
Коричневая вязкая масса. Полимер. Неустойчива, самопроизвольно превращается в ромбическую |
Рис. 2. Аллотропные модификации серы.