Задания для самостоятельной работы
1.Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
2. При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
3. С раствором щёлочи не реагирует
1)Mg 2) Zn 3) Аl 4) Be
4. С раствором сульфата меди (II) взаимодействует
1)Рb 2) Hg 3) Fe 4) Ag
5. Взаимодействием соответствующего оксида с водой нельзя получить
1) Си(ОН)2 2) Ва(ОН)2 3) H2SO4 4) NaOH
6. Медь из раствора сульфата меди (II) вытесняет каждый из металлов ряда
1) Na, Cr, Zn 3) Fe, Zn, Аl
2) К, Fe, Си 4) Zn, Fe, Аи
7. И с соляной кислотой, и с водой реагирует
1) аммиак 3) никель
2) хлор 4) карбонат кальция
8. В схеме превращений
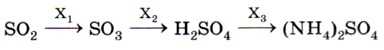
веществами Х4, Х2 и Х3 являются соответственно
1) O2, Н2O, NH3 3)O2, Н2O, N22) NO2, Н2, NH3 4) O2, Н2, NH3 • Н2O
9. Установите соответствие между названием оксида (левый столбец) и формулами веществ, с которыми он может взаимодействовать (правый столбец).

10. Установите соответствие между названием соли (левый столбец) и формулами веществ, с которыми она может взаимодействовать в водном растворе (правый столбец).

Характерные химические свойства кислот
1. Кислота + металл = соль + водород (если:
металл находится в ряду напряжений до водорода;
образуется растворимая соль;
кислота растворима).
Примечания. 1) Щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют в первую очередь с водой.
2) Азотная кислота любой концентрации и концентрированная серная кислота взаимодействуют с простыми веществами по-особому.
2. Кислота + оксид металла (основный или амфотерный) = соль + вода.
3. Кислота + основание (гидроксид или бескислородное основание) = соль + вода (для бескислородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок или газ).
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щёлочь = новая соль + новое основание (если образуется осадок или газ).
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок).
4. Соль (раствор) + металл = новая соль + новый металл (если:
металл находится в ряду напряжений слева от металла, образующего соль;
Химические свойства оснований
Для оснований характерны реакции обмена с кислотами и солями, реакции соединения с кислотными оксидами и реакции термического разложения.
Изменение окраски индикаторов
Вы уже знаете, что такое индикаторы и для чего они используются. Вспомните, в какие цвета окрашиваются лакмус, метилоранж и фенолфталеин в растворах щелочей.
Взаимодействие с кислотами
Практически все основания реагируют с кислотами с образованием солей по общей схеме:
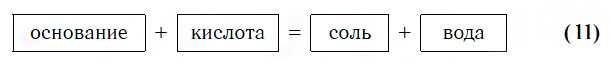
Пример реакции, протекающей в соответствии с указанной схемой:
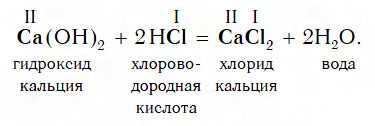
В результате реакции между щелочью и кислотой образуется раствор соли, в котором уже нет ни щелочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык означает «ни тот ни другой».
Напомним, что реакция между щелочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
Взаимодействие с кислотными оксидами
Все щелочи реагируют с кислотными оксидами по общей схеме:

Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
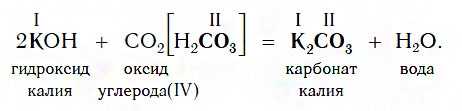
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в квадратных cкобках), то в составе образующейся соли будет остаток этой кислоты — PO4 с валентностью, равной III:
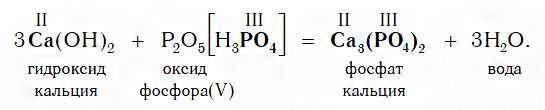
Взаимодействие с солями
Все щелочи реагируют с солями по общей схеме:

Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества — щелочь и соль — обмениваются своими составными частями. При этом валентность атомов металлов и кислотных остатков не изменяется.
Термическое разложение
Все нерастворимые основания при нагревании разлагаются по общей схеме:

Краткие выводы урока:
- Основания делятся на растворимые в воде (щелочи) и нерастворимые.
- Все основания реагируют с кислотами. Растворимые основания реагируют с кислотными оксидами и солями. Нерастворимые основания подвергаются термическому разложению.
Надеюсь урок 37 «Основания» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Основания (названия, получение, свойства)
Ключевые слова конспекта: основания, названия оснований, получение оснований, химические свойства.
Содержание (быстрый переход):
Гидроксиды — неорганические соединения, содержащие гидроксильную группу -OH. В зависимости от проявляемых свойств различают:
— Основные гидроксиды (основания), включая Щёлочи (хорошо растворимые в воде основания).
— Амфотерные гидроксиды, проявляющие в зависимости от условий либо основные, либо кислотные свойства.
— Кислотные гидроксиды (неорганические кислородсодержащие кислоты).
Классификация гидроксидов совпадает с классификацией соответствующих солеобразующих оксидов.
Будьте внимательны! Термин «гидроксиды» часто применяют по отношению к основным и амфотерным гидроксидам! Воду также иногда называют гидроксидом водорода. Ниже по тексту этой статьи термин «гидроксид» применяется в отношении основных и амфотерных гидроксидов.
Основаниями называют соединения металлов с гидроксогруппами ОН (одна или несколько групп ОН на каждый атом металла М, т.е. МОН или М(ОН)n). Гидроксогруппа ОН – это ион, ее заряд равен 1–, валентность I.
Названия оснований
В названии основания два слова: КОН – гидроксид калия. Если металл имеет переменную валентность, то ее указывают римской цифрой в скобках: Сг(ОН)3 – гидроксид хрома(III).
Чтобы составить формулу гидроксида по названию соединения, надо знать заряд катиона металла Мn+. Число гидроксогрупп в формуле равно величине этого заряда: М(ОН)n. Заряды катионов металлов можно узнать из таблицы растворимости. Например, в гидроксиде калия заряд иона калия 1+, К+, поэтому формула КОН. В гидроксиде бария ион бария Ва2+, формула Ва(ОН)2.
К щелочам относятся гидроксиды металлов подгрупп IA и IIA (начиная с кальция) периодической системы химических элементов, например NaOH (едкий натр), KOH (едкое кали), Ba(OH)2 (едкий барий). В качестве исключений к щелочам относят гидроксид одновалентного таллия TlOH, который хорошо растворим в воде и является сильным основанием, и гидроксид европия(II) Eu(OH)2. Щёлочи — это сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением
«Едкие щёлочи» — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH и цезия CsOH. Название «едкая щёлочь» обусловлено свойством разъедать кожу и слизистые оболочки (вызывая сильные химические ожоги), бумагу и другие органические вещества. При работе с ними надо особенно тщательно соблюдать правила техники безопасности, надевать очки и перчатки.
Для распознавания растворов щелочей используют индикаторы.
Индикаторы – это органические красители, изменяющие окраску в зависимости от состава раствора. Так, бесцветный раствор фенолфталеина в растворе щелочи становится малиновым. Фиолетовый раствор лакмуса в растворах щелочей становится синим, а оранжевый раствор метилоранжа приобретает интенсивно желтый цвет.
Нерастворимые основания – это практически нерастворимые в воде вещества, например гидроксид железа(III), гидроксид меди(II), гидроксид магния.
Основные оксиды – это оксиды, которым соответствуют основания. Если элемент образует несколько оксидов, то оксид, соответствующий низшей степени окисления, является основным оксидом. Например, СrО и МnО – основные оксиды.
Формулы основных оксидов можно вывести, вычитая необходимое число молекул воды из формулы основания. Например, для формул основных оксидов Na2O, СаО, Fe2O3:
а) 2NaOH – Н2O = Na2O;
б) Са(ОН)2 – Н2O = СаО;
в) 2Fe(OH)3 – 3Н2O = Fe2O3.
Получение оснований
Растворимые основания получают:
а) реакцией оксидов щелочных и щелочноземельных металлов с водой: ВаО + Н2O = Ва(ОН)2;
Нерастворимые основания получают по реакции обмена растворимых солей со щелочами:CuCl2 + 2NaOH = Cu(OH)2 ↓ + 2NaCl.
Химические свойства оснований
Нерастворимые основания – довольно неустойчивые соединения. Нагревание (300–400 °С) приводит к потере ими воды. Например, голубой гидроксид меди(II) при нагревании отщепляет воду и превращается в черный оксид меди(II): Сu(ОН)2 → t → СuО + Н2O.
Вы смотрели: конспект урока по химии в 8 классе «Основания».
Классификация оснований
По растворимости в воде основания делятся на растворимые и нерастворимые. К растворимым основаниям относятся NaOH, KOH, Ba(OH)2, Ca(OH)2. Они имеют общее название — щёлочи. При обычных условиях это твердые вещества белого цвета. Нерастворимыми являются основания Mg(OH)2, Al(OH)3, Zn(OH)2, Fe(OH)2, Fe(OH)3 и некоторые другие. Они также представляют собой твердые вещества, многие из которых окрашены в разные цвета (рис. 120).

Термин «щёлочь» происходит от старорусского слова «щёлок», обозначавшего отвар чего-либо в воде. Этим словом называли, например, жидкость, которая получается при кипячении смеси воды с золой растений. Вещество, содержащееся в золе, реагирует с водой и превращается в гидроксид калия KOH. Это соединение, содержащееся в щёлоке, назвали «щёлочь». Впоследствии данный термин стали использовать для всех растворимых оснований.
Примеры тестовых заданий и рекомендации к их выполнению
1. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) А1, Zn, Си 3) Mg, Zn, Fe
2) Zn, Fe, Pb 4) Pb, Си, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II)— практически нерастворимая соль, о чём свидетельствует соответствующая клеточка в таблице растворимости. Ответ: 3.
2. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1,2 и 4. Ответ: 3.
3. С раствором хлорида меди (II) не реагирует
1)Мg 2) Zn 3) Fe 4) Ag
Лёгкое задание на знание ряда напряжений металлов. Ответ: 4.
4. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида — щёлочи. Следовательно, это должен быть оксид щелочного или щёлочноземельного металла. Ответ: 3.
5. С гидроксидом бария реагирует каждое из веществ, формулы которых
1) NaCl, Na2SO4, Na2CO3 3) ZnO, K2O, CO22) HNO3, NaOH, K2SO4 4) Al(OH)3, CuSO4, HCl
Так как Ba(OH)2 — щёлочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ — 4. К такому же результату можно прийти, исключив варианты 2 (он включает щёлочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта — соли, но если две последние соли образуют осадок с гидроксидом бария, то первая — нет. Ответ: 4.
6. В цепочке превращений
S → X1 → SO3 → Х2 → CuSO4 → Х3 → CuO → Сu
веществами Х1, Х2 и Х3 являются соответственно
1) H2S, H2SO4, Cu(OH)2 3) SO2, H2SO4, CuCl22) FeS, H2SO4, Cu(OH)2 4) SO2, H2SO4, Cu(OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, a SO2. В варианте 3 первые два искомых вещества указаны верно, a CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию невозможно. Ответ: 4.
7. Установите соответствие между веществом, реагирующим с железом (левый столбец), и названием железосодержащего продукта, который при этом образуется (правый столбец).
Задание выполнить несложно, так как из числа приведённых в условии реагентов только сильный окислитель — хлор окисляет железо до степени окисления +3 (соответствие А — 4). Остальные реагенты окисляют его до степени окисления +2. Ответ: 4251.
8. Установите соответствие между названием вещества (левый столбец) и названием продукта его горения (правый столбец).
Знание химических свойств простых веществ, указанных в левом столбце, позволит легко установить верные соответствия. Ответ: 635.
9. Установите соответствие между исходными веществами (левый столбец) и продуктами их взаимодействия (правый столбец).
Вначале исключается заведомо неверный вариант 6 (в водной среде образование оксида кальция невозможно). Очевидно, необходимо исключить и вариант 1, так как для него нет соответствующей левой части уравнения. Некоторые сложности может вызвать соответствие Г — 5, основанное на знании перехода карбоната в гидрокарбонат и обратно. Ответ: 4325.
10. Установите соответствие между названием оксида (левый столбец) и формулами веществ, с которыми он взаимодействует (правый столбец).
В соответствии с рекомендациями для задания 1 для оксида хрома (В) исключаются варианты 1, 2, 4, 6 и устанавливается соответствие с 5 (как амфотерный оксид, Сr2O3 взаимодействует с щелочами, а также восстанавливается алюминием). Оксид калия, как основный, взаимодействует с веществами группы 4. Несолеобразующий оксид углерода (II) является восстановителем и вступает в реакции с веществами группы 3: взаимодействием СО с Н2 получают метанол, восстанавливают железо из оксидов (чёрная металлургия) и используют как газообразное топливо (генераторный газ).
Кислотный оксид азота (V) взаимодействует с веществами группы 1. Ответ: 4351.





























