Важность гибкости классификации
Гибкость классификации элементов на металлы и неметаллы является важным фактором при изучении химических свойств и поведения различных веществ. Универсальность такой классификации позволяет учитывать широкий спектр химических элементов и реагировать на их изменения в различных условиях.
Важность гибкости классификации связана с тем, что амфотерность элементов может указывать на их способность проявлять как металлические, так и неметаллические свойства. Это позволяет более точно определить химическую активность и реакционную способность этих элементов
Наличие гибкой классификации также способствует более точной системе обозначений и номенклатуре химических соединений
Важно иметь возможность точно указывать свойства элементов и соединений для более эффективной коммуникации в научных и промышленных средах
Гибкая классификация элементов также позволяет учитывать их изменение свойств в зависимости от окружающей среды, температуры, давления и других факторов
Это особенно важно при проведении экспериментов и исследований, а также при разработке новых материалов и технологий
Свойства металлов Al и Zn как простых веществ
Цинк – довольно плотный металл. Сохраняет свои качества в небольшом диапазоне температур: при низких значениях (до -30) становится хрупким, при температурах выше 100С очень пластичен. Это используется в металлургии, прокатывая цинковые листы толщиной несколько миллиметров (цинковая фольга). Некоторые примеси резко повышают хрупкость металла, поэтому используется очищенный материал.

Al – сильно пластичный легкий металл с низкой температурой плавления. Обладает высокой ковкостью и электропроводностью.
На воздухе он покрывается оксидной пленкой поэтому практически не подвергается коррозии. Благодаря этому он используется при изготовлении проводов и корпусов машинной техники.
Преимущества гибкой классификации
Гибкая классификация элементов на металлы и неметаллы обеспечивает ряд преимуществ, которые важны как в научных исследованиях, так и в промышленности.
1. Учет особенностей химических свойств элементов. Гибкая классификация позволяет учитывать особенности химических свойств каждого элемента и определять его взаимодействие с другими веществами. Это особенно полезно для прогнозирования реакций и разработки новых материалов с определенными свойствами.
2. Понимание амфотерности элементов. Гибкая классификация позволяет более глубоко изучать амфотерность элементов, то есть их способность проявлять как металлические, так и неметаллические свойства в зависимости от условий. Это дает возможность лучше понять и объяснить физико-химические процессы, происходящие в природе и в различных технологических процессах.
3. Расширение границ классификации. Гибкая классификация позволяет более точно определять границы между металлами и неметаллами, а также включать в классификацию элементы, которые ранее не подпадали ни под одну из этих групп. Такое расширение границы классификации открывает новые возможности для исследований и разработки новых материалов.
В целом, гибкая классификация элементов на металлы и неметаллы позволяет более глубоко изучать и понимать химические свойства элементов, амфотерность и расширяет возможности для прогнозирования реакций и разработки новых материалов с определенными свойствами.
Химические свойства алюминия и цинка
Оба вещества способны реагировать как обычные металлы. Так же, есть ряд специфических реакций.
Взаимодействие с неметаллами
С неметаллами и оба вещества взаимодействуют с образованием бинарных соединений – солей. Как правило, скорость течения реакции и условия зависят от активности неметалла. Так, с кислородом реакция идет реакция образования оксида при нагревании с цинком:
2Zn + O2 = 2ZnO
с алюминием в обычных условиях:
4Al + 3O2 = 2Al2O3
Оксид алюминия покрывает изделие плотной пленкой (оксидная пленка) и доступ кислорода прекращается, поэтому, для полной реакции его нужно брать в порошке.
Zn не реагирует с Br, N2, Si, C, H2.
Al не вступает в реакцию только с H2.
Взаимодействие с металлами
С восстановителями оба металла образуют сплавы:
- Алюминиды CuAl2, CrAl7, FeAl3
- Латунь ZnCu
Это не является химической реакцией, так как не происходит передачи электронов или изменения химических свойств веществ.
Взаимодействие с кислотами и щелочами
С кислотами и алюминий, и цинк взаимодействуют при обычных условиях с образованием солей:
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O;
2Al + 6HCl = 2AlCl3 + 3H2;
Zn + 2HCl = ZnCl2 + H2;
Zn + H2SO4 = ZnSO4 + H2.
Результат реакции со щелочами зависит от условий реакции: если реакция идет в растворе (в присутствии воды), то образуются комплексные соли:
2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2;
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2.
В безводной среде (сплавление) образуются соли металлических кислот:
Zn + 2KOH = K2ZnO2 + H2 (K2ZnO2 – цинкат калия);
2Al + 6KOH = 2KAlO2 + 2K2O + 3H2 (KAlO2 – алюминат калия).
Взаимодействие с водой
Алюминий активно взаимодействует с водой, если очистить оксидную пленку. Реакцию нужно проводить быстро, так как пленка образуется практически мгновенно:
2Al + 6H2O = 2Al(OH)3 + 3H2;
Zn реагирует с водой при очень высокой температуре (при накаливании до красного состояния):
Zn + H2O = ZnO + H2.
Применение гибкой классификации в химической промышленности
Гибкая классификация элементов на металлы и неметаллы предоставляет возможность широкого применения в химической промышленности. Это свойство, именуемое амфотерностью, позволяет эффективно использовать различные элементы для разных химических процессов и производств.
Одним из примеров применения гибкой классификации является использование амфотерных элементов в процессе флотации — важной операции разделения минералов от горных пород. Амфотерные соединения, такие как оксиды алюминия и железа, могут одновременно взаимодействовать и с основаниями, и с кислотами, что обеспечивает эффективное отделение минералов от горных пород
Гибкая классификация также находит применение в производстве полупроводников
При изготовлении полупроводниковых приборов, важно иметь элементы, обладающие как металлическими, так и неметаллическими свойствами. Например, амфотерными свойствами обладает кремний, который используется в производстве кристаллов для создания полупроводниковых структур
Гибкая классификация элементов также применяется в химическом синтезе различных соединений. Например, амфотерные металлы, такие как цинк и алюминий, используются в процессе синтеза органических соединений. Они позволяют эффективно контролировать реакции и получать желаемые продукты с высокой степенью чистоты и удельной активности.
В заключение, гибкая классификация элементов на металлы и неметаллы играет важную роль в химической промышленности. Амфотерность элементов позволяет эффективно применять их в различных процессах и производствах, обеспечивая высокую эффективность и качество продукции.
ХИМИЯ
Существенным отличительным признаком элементов является кислотный или основный характер соответствующих им оксидов и гидроксидов. Вы уже знаете, что металлы в степени окисления +1 и +2 образуют, как правило, основные оксиды, а в качестве гидроксидов — основания. Металлы с большим значением степени окисления (+6, +7) и неметаллы образуют кислотные оксиды, которым соответствуют кислородсодержащие кислоты.
Проведём небольшой лабораторный опыт. Получим гидроксид цинка и исследуем его химические свойства.
Лабораторный опыт № 1
Получение гидроксида цинка и исследование его свойств
| В две пробирки налейте по 1 мл раствора соли цинка (хлорида, сульфата или нитрата), а затем добавьте в каждую с помощью пипетки по 5 капель раствора щёлочи (гидроксида натрия или калия). Что наблюдаете? Прилейте к содержимому одной пробирки раствор кислоты (соляной, серной или азотной), а к другой — раствор щёлочи. Что наблюдаете? О каком свойстве гидроксида цинка свидетельствует вторая часть опыта? Запишите уравнение проделанных реакций в молекулярной и ионной формах. |
В чём причина такого необычного поведения Zn(OH)2 как нерастворимого основания? Опыт показывает, что гидроксид цинка проявляет свойства оснований, взаимодействуя с кислотой, но он также ведёт себя и как нерастворимая кислота, взаимодействуя с щёлочью.
| Вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства, называют амфотерными (от греч. амфотеро — и тот, и другой). |
Таким образом, гидроксиду цинка присущи амфотерные свойства: он может реагировать с кислотами как основание и с щелочами как кислота. Соответственно формулу этого соединения можно представить двояко:
Тогда уравнения реакций гидроксида цинка с кислотой и с щёлочью можно записать так:
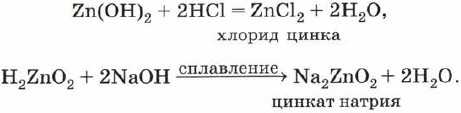
В обоих случаях образуется растворимая соль.
Аналогично гидроксиду цинка и соответствующий ему оксид цинка проявляет амфотерные свойства — образует соли при взаимодействии как с кислотами, так и с основаниями, например:
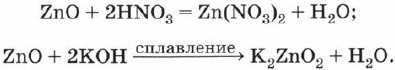
В первой реакции оксид цинка ведёт себя как основный оксид, а во второй реакции выступает в роли кислотного оксида — образует соль, в которой цинк входит в состав кислотного остатка.
Амфотерными являются оксиды и гидроксиды многих элементов, например бериллия, алюминия, хрома (III).
Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
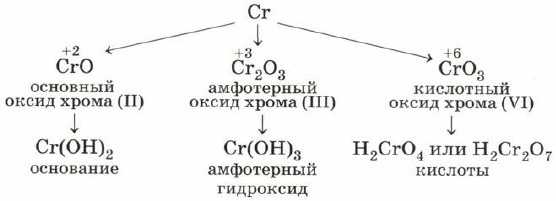
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Эти элементы называют переходными элементами или переходными металлами.
Новые слова и понятия
- Амфотерные оксиды и гидроксиды.
- Переходные элементы, или переходные металлы.
- Зависимость химических свойств оксидов и гидроксидов элементов побочных подгрупп Периодической системы Д. И. Менделеева от степеней окисления их атомов.
Задания для самостоятельной работы
-
Почему для получения амфотерного гидроксида из раствора соли переходного элемента раствор щёлочи к ней приливают по каплям?
-
Запишите уравнения реакций для следующих превращений:
Первую реакцию рассмотрите с позиций окисления-восстановления.
-
Приведите по два молекулярных уравнения реакций, соответствующих сокращённым ионным уравнениям:
- Докажите, что амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы.
Сплавы алюминия и цинка
В металлургии практически не применяются в чистом виде из-за высокой пластичности. Для того чтобы сохранить достоинства металлов, но убрать недостатки осуществляют сплавление с другими металлами.
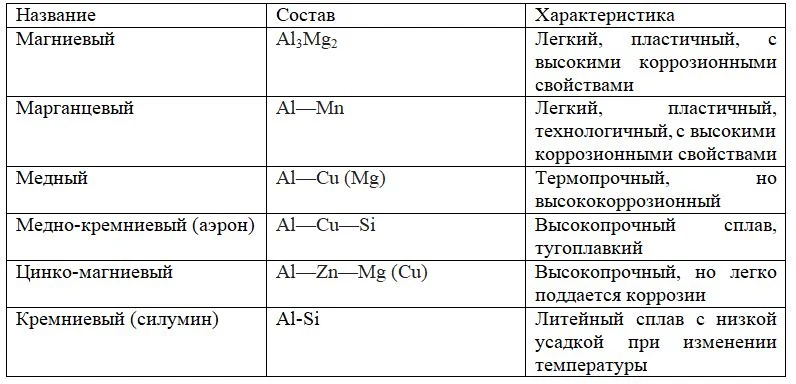
Сплавы алюминия

Сплавы алюминия делятся на две группы:
- Литейные (без сохранения пластичности);
- Конструкционные (деформируемые).
Таблица. Характеристика основных сплавов алюминия
Сплавы цинка
Самый используемый сплав цинка – латунь (Cu — Zn). Он обладает хорошими сварными свойствами, поэтому применяется в изготовлении кухонной утвари и различных изделий интерьера.

Если к этому сплаву добавляют свинец, этот сплав называется мунц-металл. Оба сплава применяются при литье труб и каркасов.
Амфотерные свойства и их значение
Амфотерными свойствами называются способности вещества образовывать как соли металлов, так и кислоты. Это значит, что амфотерные вещества могут реагировать как с основаниями, так и с кислотами, в зависимости от условий.
Значение амфотерных свойств заключается в гибкости классификации элементов на металлы и неметаллы. До открытия амфотерности металлы и неметаллы описывались как полностью различающиеся типы элементов, но благодаря этим свойствам стало понятно, что граница между ними не такая четкая, и некоторые элементы могут обладать и металлическими, и неметаллическими свойствами.
Примером амфотерных веществ являются оксиды, которые образуются при соединении элементов с кислородом. Некоторые оксиды проявляют кислотные свойства, реагируя с основаниями, а другие — щелочные свойства, реагируя с кислотами
Это подтверждает гибкость классификации элементов и важность амфотерных свойств при изучении свойств вещества
В таблице Менделеева амфотерными элементами являются, например, алюминий (Al) и цинк (Zn). Они могут образовывать соли с отрицательно заряженными ионами, а также растворяться в кислотах и образовывать положительно заряженные ионы.
Расположение амфотерных элементов в таблице Менделеева
В таблице Менделеева положение того или иного атома сообщает значительную часть информации о строении атома этого элемента и его химических свойствах. Периодической эта система называется, потому что в разных периодах (горизонтальные строчки) и группах (вертикальные столбцы) повторяется определенное качество элементов. Так, вся первая группа является щелочными металлами, а седьмая – галогенами (неметаллами), восьмая – инертными газами. Но, это характерно только для главной подгруппы. В побочной группе располагаются амфотерные элементы.
Строение атома амфотерных элементов
Особенность химических свойств амфотерных элементов связана со строением их атомов. У них происходит предзаполнение s-подуровня, из-за этого, незаполненным оказывается всегда d-подуровень. Все представители побочных подгрупп являются p- или d-элементами. В различных условиях может происходить перескок электронов с подуровней и увеличение неспаренных электронов.
Таблица. Строение атомов некоторых амфотерных элементов
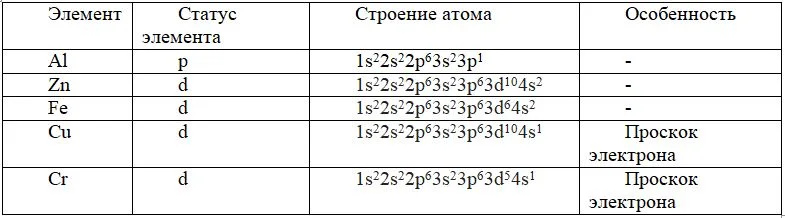
Для некоторых из них характерен проскок электрона. Это состояние, при котором электрон с последнего уровня перескакивает на следующий. По этой причине оказывается неспаренным s-электрон.
Получение алюминия и цинка
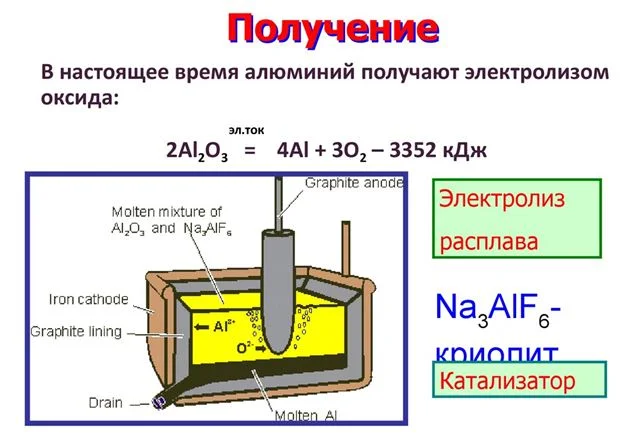
Основной способ получения металлов – выделение их из состава руды. Для этого используется наиболее богатая металлом горная порода. Алюминий получают из боксита. Этот процесс состоит из трех этапов:
- Добыча горной породы;
- Обогащение (увеличение концентрации метала за счет очистки от примесей);
- Выделение чистого вещества путем электролиза.
Получение цинка производится несколькими методами – электролитическим (так же как и Al) и пирометаллургический. Второй способ основан на восстановлении цинка из его оксида углеродом или оксидом углерода II (угарным газом):
ZnO + C ⇄ Zn + CO
ZnO + CO ⇄ Zn + CO2
Достоинство этого метода в том, что продукты первой реакции могут использоваться во второй, что снижает количество выбросов в атмосферу.
Металлы и неметаллы
Металлы и неметаллы — это две основные категории химических элементов в периодической системе. Однако разделение на металлы и неметаллы не всегда такое четкое, так как некоторые элементы проявляют свойства обеих категорий и называются амфотерными.
Металлы обладают рядом характеристических свойств, таких как высокая теплопроводность и электропроводность, гибкость и пластичность. Они также обладают металлическим блеском и способностью образовывать ионные соединения с неметаллами.
Неметаллы, в отличие от металлов, имеют низкую электропроводность и теплопроводность. Они обычно образуют ковалентные соединения с другими неметаллами. Неметаллы часто проявляют такие свойства, как прозрачность, хрупкость и нековкость.
Однако некоторые элементы, такие как алюминий и свинец, проявляют как металлические, так и неметаллические свойства. Они обладают способностью образовывать ионные соединения с неметаллами, но также могут образовывать ковалентные соединения. Эти амфотерные элементы являются примером гибкости классификации элементов в периодической системе.
Представители амфотерных элементов
Все элементы побочных групп являются амфотерными и проявляют сходные химические свойства. Наиболее распространены в природе три элемента: Al, Zn и Cr.
Цинк как амфотерный элемент
Цинк — это относительно мягкий светло-серый металл. Является одним из самых распространенных амфотерных элементов. В природе цинк встречается в составе 66 минералов, наиболее распространенные представлены в таблице.

Таблица. Минералы, в состав которых входит Zn

Цинк является d-элементом.
1s22s22p63s23p63d104s2
Химические свойства цинка обусловлены наличием незаполненной p-обитали. С s-подуровня происходит перескок электрона, за счет чего появляется два неспаренных электрона: Zn* 1s22s22p63s23p63d104s14p1.
Алюминий как амфотерный элемент
Al является самым распространенных элементом не только среди металлов, но и во всей таблице Менделеева. Он занимает 3 место после кислорода (O2) и кремния (Si).
Это мягкое вещество серебристо-серого цвета с низкой температурой плавления. В природе встречается как в виде минералов, так и в виде самородков. Является примесью многих минералов.
Наиболее распространенные минералы, содержащие Al:
- Авгит ((Ca,Na)(Mg,Fe,Al,Ti)(Si,Al)2O6)
- Боксит (Al2O3xH2O)
- Нефелин (Элиолит) ((NaK)AlSiO4)
- Алунит (K2SO4Al2(SO4)3·4Al(OH)3)
- Силлиманит ((Al2O3)(SiO2))
- Корунд (Al2O3)
Последний минерал в зависимости от примесей имеет разный окрас. Применяется в ювелирном деле и считается полудрагоценным камнем.

Его атом содержит 13 электронов, распределенных по 3 электронным уровням: 1s22s22p63s23p1. Это р-элемент, у которого может происходить переход электрона с s-подуровня на свободную р-орбиталь. За счет этого, металл приобретает 3 неспаренных электрона: Al* 1s22s22p63s13p2
Применение алюминия и цинка
Al как самый распространенный элемент широко используется в химической промышленности. Он способен вытеснять восстановители из соединений, поэтому применяется для получения металлов. Такой метод называется алюмотермия.
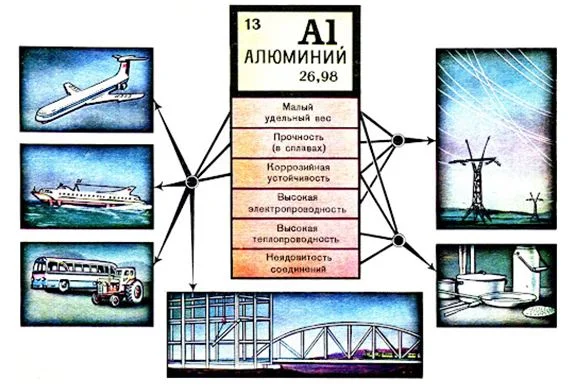
Благодаря оксидной пленке и низкой плотности используется в автомобиле-, самолето- и ракетостроении для снижения массы изделия. В строительстве алюминий применяется для изготовления каркасов высотных зданий.
Zn применяется для снижения коррозии металлических изделий –цинкование. Порошок этого металла используется для изготовления масляных красок с металлическим блеском. Также, оксид служит в качестве антисептика. Мази на основе цинкового порошка используются в лечении лишаев и других инфекционных поражений кожи.
Амфотерность элементов
Амфотерность — это свойство некоторых химических элементов проявлять свойства как металлов, так и неметаллов в определенных условиях. Такие элементы могут проявляться как щелочные металлы при реакции с кислотой, и как кислотные оксиды при взаимодействии со щелочами.
Одним из примеров амфотерных элементов является германий. Германий обладает металлическими свойствами, но также может проявлять и неметаллические свойства в некоторых реакциях. Например, через реакцию с щелочью германий образует германиевую соль, действуя как металл. Однако, при взаимодействии с кислотой германий образует гидрогерманат, проявляя кислотные свойства.
Другим примером амфотерных элементов являются алюминий и цинк. Алюминий может проявлять свойства металла, но при реакции с гидроксидом натрия образует алюминат натрия, проявляя свойства щелочи. Цинк, в свою очередь, обычно проявляет свойства металла, но при реакции с кислотой образует соответствующую соль, проявляя кислотные свойства.
Амфотерность элементов свидетельствует о гибкости классификации в химии, где в зависимости от условий взаимодействия элементы могут проявлять различные свойства. Это позволяет более точно описывать химические реакции и взаимодействия веществ, что является важным в науке и технологиях.
Важность гибкости для научных исследований
В научных исследованиях гибкость является одним из ключевых факторов, в особенности при классификации элементов на металлы и неметаллы. Гибкость позволяет рассматривать элементы не только с точки зрения предопределенных свойств, но и учитывать их потенциальные амфотерные свойства. Амфотерность свидетельствует о способности элементов проявлять как металлические, так и неметаллические свойства в различных условиях.
Изучение гибкости классификации элементов на металлы и неметаллы имеет важное значение для понимания их физических и химических свойств. Знание амфотерности позволяет расширить область применения элементов, оптимизировать процессы производства и создания новых материалов
Гибкость классификации элементов также содействует углублению научных знаний и развитию научных теорий. Изучение амфотерных свойств элементов позволяет расширить границы понимания химических процессов и явлений, открывая новые возможности для научных открытий и разработок.
Таким образом, гибкость классификации элементов на металлы и неметаллы играет важную роль в научных исследованиях. Амфотерность элементов открывает перед нами широкие перспективы в области применения и углубления наших знаний о мире химических реакций и веществ.
Примеры амфотерных элементов
Амфотерность – это способность определенных элементов взаимодействовать и реагировать как с кислотами, так и с щелочами. Такие элементы обладают свойствами и металлов, и неметаллов, что делает их уникальными. Примеры амфотерных элементов включают в себя следующие вещества:
- Галлий (Ga): Галлий является металлом, который при взаимодействии с кислотами образует соответствующие соли. Однако он также может реагировать с щелочами, образуя гидроксид галлия (Ga(OH)3), который обладает щелочными свойствами.
- Сурьма (Sb): Сурьма также проявляет амфотерные свойства. Она формирует соль с кислотами и образует щелочной гидроксид, который может реагировать с кислотами.
- Свинец (Pb): Свинец может реагировать с различными типами кислот и образовывать соответствующие соли. Кроме того, свинец может образовывать щелочные гидроксиды.
Эти примеры демонстрируют амфотерные свойства различных элементов и подтверждают гибкость классификации веществ на металлы и неметаллы
Амфотерные элементы имеют важное значение как в химической промышленности, так и в различных областях науки и технологий





























