Обратимость химических реакций
Химические процессы могут протекать как в одну, так и в обе стороны. Последние называются обратимыми.
Чаще всего, в таких реакциях устанавливается равновесие – это значит, она идет с одинаковой скоростью в обоих направлениях. Зафиксировать тот или иной продукт становится сложно. В основном, направление процесса изменяется при повышении концентрации одного из реактивов.
Практически любая реакция, в которой не образуется окончательный продукт – газ, осадок или вода – являются обратимыми, так как ионы в растворе соединяются как в исходные молекулы, так и в продукты реакции с одинаковой скоростью. Зафиксировать образование одного из продуктов реакции не представляется возможным.
Обратимым реакциям можно задать определенное направление, используя катализаторы:
Например, в реакции получения аммиака из водорода и азота – 3H2 + N2 ⇌ 2NH3 –в качестве катализатора используют порошок железа, смещающего равновесие в сторону прямой реакции.
Для разных обратимых процессов характерны специфические катализаторы, ускоряющие прямой или обратный процесс.
Таблица. Условия протекания обратимых реакций
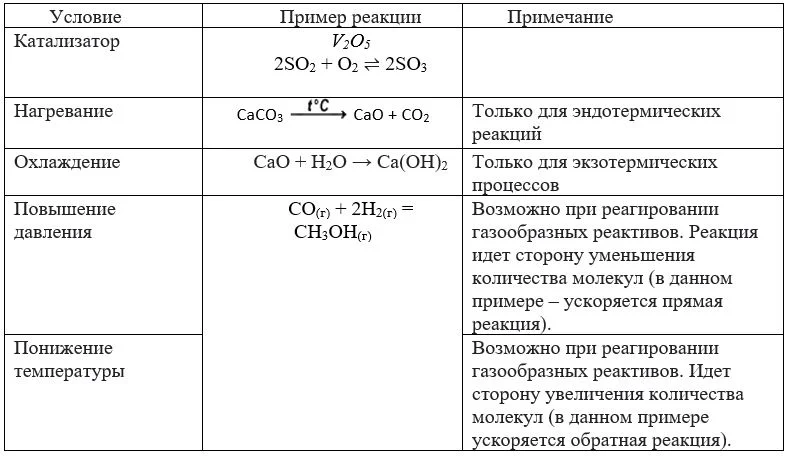
Изменение объема смеси взаимодействующих веществ не влияет на скорость, так как увеличение количества молекул не ускоряет их движение. А вот повышение чистоты реагентов может увеличить скорость реакции, так как увеличит вероятность столкновения нужных реагентов. Правда, в ряде случаев (серная и азотная кислота) изменение концентрации приводит к изменению состава продуктов.
Иногда, для течения реакции в определенно направлении нужно отводить продукт ее протекания: собирать осадок, газ или осаждать один из растворимых продуктов.
Таким образом, считается, что реакция идет, если мы можем увидеть или проверить с помощью специальных реактивов (индикаторов) образование новых продуктов. Если реакция идет в обоих направлениях, то она считается обратимой. В таком случае, ускорить ее в определенном направлении можно изменением условий (давление, температура, катализатор) или отведением одного из продуктов реакции.
Химия 9 класс: все темы кратко
Краткий курс «Химия 9 класс» сгруппирован в четыре блока, содержание каждого из которых рассматривается в отдельном параграфе — «Вещества», «Химические реакции», «Основы неорганической химии» и «Методы познания веществ и химических реакций». Материал каждого параграфа представляет собой схематическое обобщение уже изученного вами материала в виде схем, таблиц, уравнений.
Повторение курса химии в 9 классе позволит вам систематизировать знания о веществах и химических реакциях
Внимание! Данный курс не является материалом для изучения химии с нуля. Он ориентирован на повторение пройденного материала (экспресс-обзор)
Данный курс не является материалом для подготовки к ОГЭ по химии. При подготовке к ОГЭ используйте другие материалы сайта.
Содержание (быстрый переход):
Использованы цитаты из учебника для общеобразовательных учреждений «Химия 9 класс / О.С. Габриелян, И.Г. Остроумов, С.А. Сладков — М.Просвещение, 2018» в учебных целях.
1. ВЕЩЕСТВА
Классификация химических реакций
Химические реакции следует отличать от физических явлений. При химических реакциях происходит превращение одних веществ в другие, в то время как при физических явлениях состав веществ не претерпевает изменений.
Признаками химических реакций могут служить:
- изменение цвета;
- выпадение осадка;
- выделение газа;
- изменение окраски индикатора;
- появление запаха и др.
Следует помнить, что ни один из перечисленных признаков не гарантирует протекание химической реакции, а лишь указывает на возможное её осуществление.
Классификация химических реакций по различным признакам приведена в таблице 6.
Электролиты и неэлектролиты.
Электролитическая диссоциация
Реакции ионного обмена
Протекание реакций обмена с участием электролитов в растворах (реакции ионного обмена) возможно при соблюдении одного из условий (правило Бертолле):
- выпадение осадка;
- выделение газа;
- образование слабого электролита (в частности, воды).
Противоположно заряженные ионы, которые при соединении образуют малорастворимое вещество, газ или молекулы слабого электролита, совместно существовать в растворе без взаимодействия не могут.
Получение неорганических веществ
В смотрели «Химия 9 класс: краткий курс повторения»
Всё самое важное вкратце, все формулы и определения за курс 9 класса. Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ответы на вопрос
Отвечает Малиновская Елена.
Ваш эксперимент с содой и уксусом является классическим примером химической реакции между кислотой и основанием. Давайте разберемся подробнее.
Наблюдение:
- Шипение и выделение газа: Когда вы добавили уксус к соде, вы, вероятно, заметили шипение и образование пузырьков. Это происходит из-за выделения углекислого газа.
- Тепловыделение: Могло также ощущаться небольшое тепловыделение.
- Изменение консистенции: Смесь стала более жидкой по сравнению с исходной содой.
Вывод:
- Химическая реакция: Произошла реакция нейтрализации, где кислота (уксус) и основание (сода) вступают в реакцию с образованием соли, воды и углекислого газа.
- Продукты реакции: Уксусная кислота (CH3COOH) в уксусе реагирует с натрия бикарбонатом (NaHCO3) в соде, образуя ацетат натрия (CH3COONa), воду (H2O) и углекислый газ (CO2).
- Образование газа: Углекислый газ образует пузырьки, вызывая шипение. Это самая заметная часть реакции.
Этот простой эксперимент демонстрирует основные принципы химии и является отличным способом наглядно показать реакцию нейтрализации.
Признаки химической реакции
Признак химической реакции – видимое изменение в реакционной смеси, по которому мы можем определить, что реакция прошла.
Такие признаки могут быть видны сразу:
- Выделение газа;
- Выпадение осадка;
- Растворение осадка
- Изменение цвета;
- Свечение;
- Появление специфического запаха
Иногда, констатировать процесс реакции можно только с использованием дополнительных реактивов:
- Изменение кислотности раствора;
- Образование продукта, вступающего в специфическую реакцию с видимыми изменениями характеристик реакционной смеси.
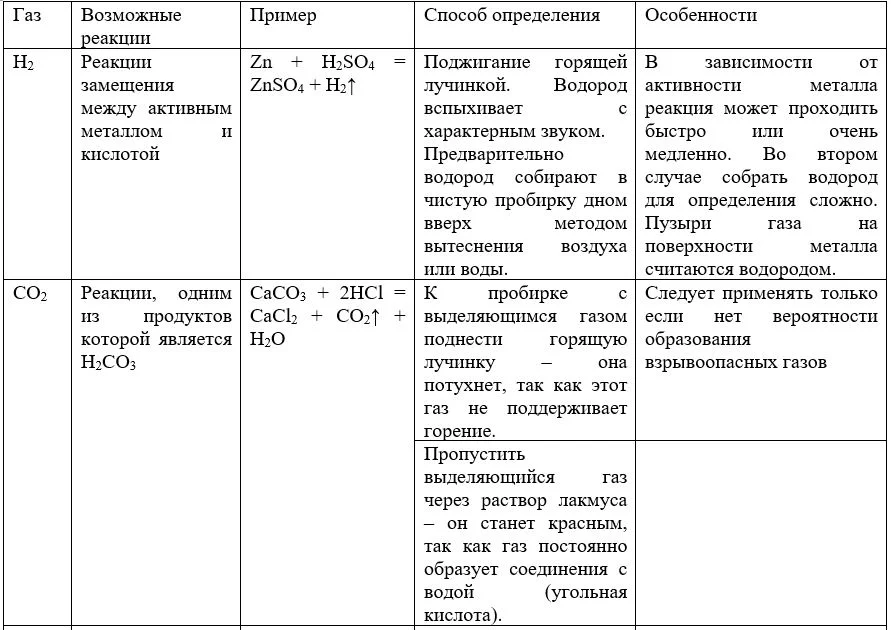
Выделение газа
Выделение газа происходит при образовании газообразного продукта или слабого электролита, распадающегося с выделением газа. Основной сложностью является идентификация образовавшегося продукта. Для каждого вещества существуют специфические признаки, идентифицирующие его.
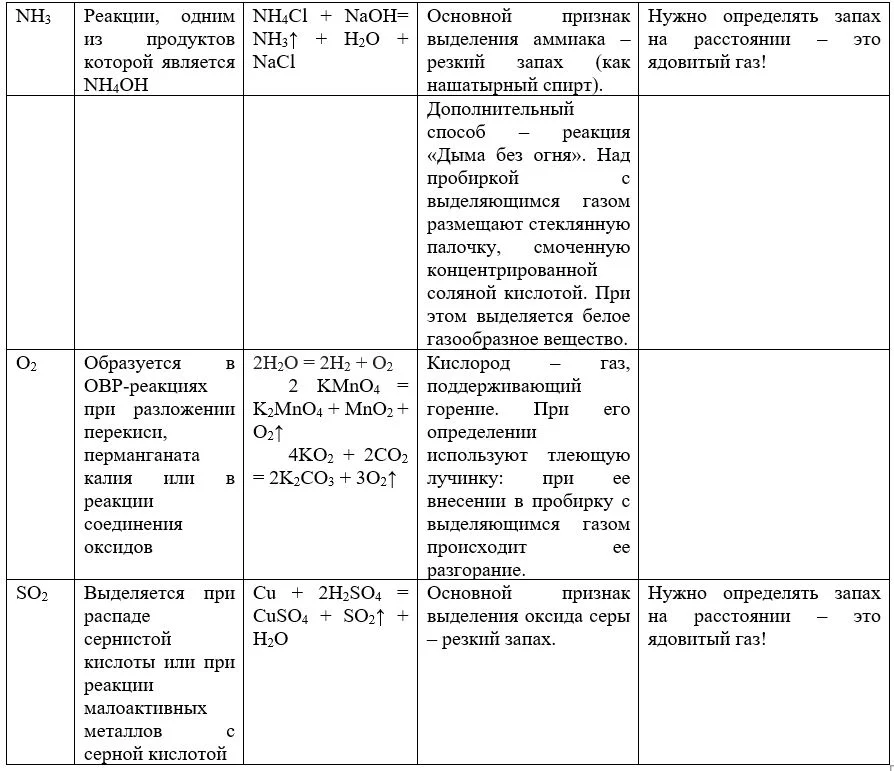
Таблица. Газ и методы его определения
Выпадение осадка
Запомнить в какой реакции произойдет выпадение осадка не нужно. Это можно определить по таблице растворимости.
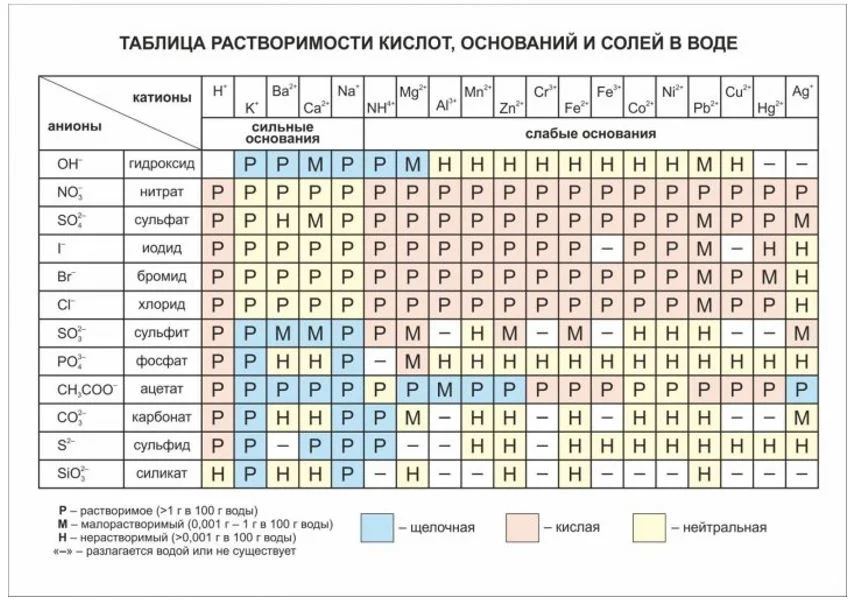
Осадки разных соединений отличаются по цвету и размеру кристаллов. Многие соединения имеют белый цвет:
- Карбонат кальция (растворим в кислотах);
- Сульфат бария (мелкокристаллический, нерастворим в кислотах);
- Гидроксид магния (аморфный);
- Гидроксид алюминия (студенистый);
- Гидроксид цинка (растворим в избытке щелочи);
- Фосфат кальция;
- Кремниевая кислота (коллоидная масса).
Ряд солей имеют желтый цвет:
- Бромид серебра (светло-желтый);
- Сульфат кадмия;
- Фосфат серебра.
Ярко-красное окрашивание характерно для гесацианоферрата калия, а гексацианоферрат железа – синий.
Сульфаты большинства металлов черного цвета.
Свечение
Люминесценция – редки признак химической реакции. Это часто наблюдается в живой природе у растений (в процессе фотосинтеза) и животных (светлячки).
К химии это можно наблюдать при использовании специального вещества – люминола. Такие реакции широко распространены в криминалистике, так как люминол очень чувствителен к органическим веществам. Причем, по цвету и степени свечения можно определить примерный состав и время оставления обнаруженного следа.
Появление специфического запаха
Запах можно почувствовать при образовании газов. Основные газы? из них – аммиак и оксид серы (IV). Такие вещества ядовиты, поэтому их идентификация без соблюдения техники безопасности может привести к отравлению и ожогу слизистой носа.
Изменение кислотности раствора
В реакции может происходить образование кислот, оснований или солей. Изменение кислотности можно определить добавив индикатор. В химии используются три основные индикатора: фенолфталеин, метилоранж, лакмус.
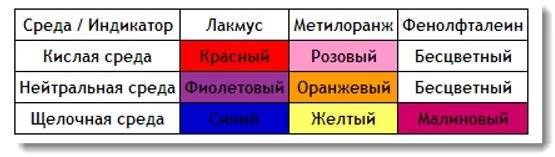
Для определения щелочи лучше всего использовать фенолфталеин, так как он меняет цвет только в этой среде. Самым неудобным индикатором для определения кислотности среды является метилоранж, так как различить в реальности оранжевый и желтый бывает сложно.
Кроме растворов индикаторов можно использовать индикаторную бумагу: она может быть пропитана одним индикатором или всеми одновременно. Последняя называется универсальной. С помощью такой бумаги можно определить не только среду – кислая, щелочная или нейтральная, но и более точное значение pH. Такая бумага очень чувствительна. Вместе с ней предоставляется шкала изменения цвета и соответствующие значения pH.
У индикаторной бумаги разных марок шаг чувствительности разный и варьирует от единиц до сотых.
В медицине определение кислотности имеет важное значение, так как многие процессы идут при определенной кислотности. Так, в ротовой полости среда щелочная и фермент слюны – амилаза – работает только в такой среде
В желудке среда кислая, что важно для пищеварительных ферментов желудка. При различных заболеваниях или вредных привычках может изменяться параметр кислотности, что служит важным диагностическим признаком.
Химические явления (реакции)
Всегда ли вещества остаются неизменными? Нагреем красную медную проволоку в пламени спиртовки. Проволока покрывается черным налетом, который можно легко соскоблить ножом в виде черного порошка. Это уже новое вещество, в которое превратилась медь. Оно отличается от меди по цвету и плотности. В этом опыте мы наблюдаем химическое явление, которое происходит благодаря химической реакции.
Химические реакции — это явления, при которых происходит превращение одних веществ в другие.
Природа — это огромная лаборатория, в которой непрерывно происходит образование новых веществ. Горные породы и минералы под воздействием солнца, воды, углекислого газа и других веществ постепенно разрушаются и превращаются в новые вещества. В зеленых растениях из углекислого газа и воды образуются глюкоза и крахмал.
Человек превращает взятые из природы вещества (природный газ, нефть, руды) в необходимые ему бензин, резину, пластмассы, волокна, металлы. Часто в результате множества превращений получаются новые вещества, которых нет в природе. При всех этих явлениях происходит разрушение исходных веществ и образование новых веществ.
Например, в результате сгорания магния образуется новое вещество MgO (рис. 50). При сгорании метана получаются два вещества: углекислый газ CO2 и вода H2O. Из одного сложного вещества HgO в результате его разложения образуются два новых — ртуть Hg и кислород O2 (рис. 51).
Ржавление железа (рис. 52), кипячение воды, горение лучины, распространение запаха — какие из этих явлений можно отнести к химическим реакциям? По каким признакам можно судить, что химическая реакция произошла?
Практическая работа №1. Изучение влияния условий проведения реакции на её скорость
Выберите верный вариант ответаВопрос 1. Какое вещество в опытах используется в виде гранул?
цинк мел соляная кислота вода
Вопрос 2. С каким из металлов не взаимодействует соляная кислота?
цинк медь алюминий магний
Вопрос 3. В каком виде мел быстрее реагирует с кислотой?
мел, растворенный в воде небольшой кусочек мелкий порошок стандартный размер школьного мела
Вопрос 4. Какой признак реакции наблюдается при взаимодействии металлов с кислотами?
выделение газа образование осадка изменение цвета вещества разложение вещества на составные части
Вопрос 5. Какое вещество используется для ускорения разложения пероксида водорода?
оксид марганца поваренная соль вода соляная кислота
Вопрос 6. Какой объем кислоты быстрее прореагирует с мелом при одинаковой концентрации?
1 миллилитр 1 грамм 1 моль 1 литр
Вопрос 7. При какой концентрации кислоты образование водорода будет происходить быстрее?
10% 30% 15% 25%
Вопрос 8. Какая лучинка используется для определения кислорода?
вырезанная из древесины лиственных пород деревьев хорошо высушенная тлеющая обработанная специальным составом
Вопрос 9. Какая из кислот в растворах не взаимодействует с металлами?
азотная кремниевая угольная серная
Отметьте верные утверждения
Результаты тестирования
Незарегистрированный посетитель
2023-10-16 08:43:37
50%
3
Незарегистрированный посетитель
2023-10-15 18:08:04
0%
Незарегистрированный посетитель
2023-10-14 21:21:31
92%
5
Незарегистрированный посетитель
2023-10-14 21:21:10
92%
5
Незарегистрированный посетитель
2023-10-14 21:20:52
92%
5
Незарегистрированный посетитель
2023-10-14 21:20:27
92%
5
Незарегистрированный посетитель
2023-10-14 21:19:47
75%
4
Незарегистрированный посетитель
2022-09-28 19:54:04
92%
5
Незарегистрированный посетитель
2022-03-23 11:14:01
100%
5
Незарегистрированный посетитель
2022-03-23 11:13:40
92%
5
Незарегистрированный посетитель
2022-03-23 11:10:22
25%
1
Незарегистрированный посетитель
2022-03-22 23:38:16
0%
Тарасов Сергей Николаевич
2022-03-22 23:00:45
100%
5
Тарасов Сергей Николаевич
2022-03-22 22:59:35
67%
3
Незарегистрированный посетитель
2022-03-16 13:06:34
100%
5
Незарегистрированный посетитель
2022-03-16 13:06:16
92%
5
Всего комментариев: 0
Последние заданные вопросы в категории Химия
Химия 09.01.2024 01:03 391 Юдаева Ульяна
Запишите диссоциацию веществ: NaOH, BaSO4, H3PO4, CuSO4, Fe(OH)3, ZnCl2, Ba(OH)2, Na2SO3, ZnSiO3,
Ответов: 1
Химия 08.01.2024 20:37 281 Сергеев Никита
Краткому ионному уравнению 2H++S2-=H2S соответсвует взаимодействие между
Ответов: 1
Химия 08.01.2024 20:25 405 Пряничников Александр
Насыпал на блюдце немного соды и добавил по каплям столовый уксус Вывод : -? Наблюдение : -?
Ответов: 1
Химия 08.01.2024 18:47 275 Бренюк Паша
1 В предложенном перечне укажите название электролита, при диссоциации которого в качестве катионов
Ответов: 1
Химия 08.01.2024 15:31 182 Белоусова Амалия
Расставить степени окисления у атомов для следующих веществ: 1.MnCI4 2.Cu20. 3.Na2S 4.NaOH
Ответов: 1
Химия 08.01.2024 14:21 209 Дорошина Елена
Выберите пары, вещества в которых могут реагировать с образованием хлороводорода. H2 и Cl2 H2S и
Ответов: 1
Химия 08.01.2024 11:36 188 Шалимова Машуля
нужно рассчитать массу 2 моль газа водорода и число молекул в этом количестве вещества. с \»дано\»
Ответов: 1
Химия 08.01.2024 11:20 213 Кошля Аліна
Оксиду кальция массой 28 г соответствует количество вещества: 1) 1 моль 2) 0, 1 моль 32 моль 4105
Ответов: 1
Химия 08.01.2024 09:36 180 Булихова Анастасия
1. Какова масса 3,01×1023 атомов железа? 2. Какова масса 0,2 моль серной кислоты H2SO4? 3. Какое
Ответов: 1
Химия 08.01.2024 09:43 122 Кирьянова Юлия
Определите валентность элемента, стоящего на первом месте в формуле газа, который выделяется в
Ответов: 1
Задания
§1. Окислительно-восстановительные реакции
1
2
3
4
5
6
Тестовые задания
§2. Тепловые эффекты химических реакций
2
3
4
§3. Скорость химических реакций
1
2
3
4
Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии
2
3
Тестовые задания
§6. Сущность процесса электролитической диссоциации
1
2
3
4
§7. Диссоциация кислот, оснований и солей
1
2
3
Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации
1
2
3
4
Тестовые задания
§9. Реакции ионного обмена
1
2
3
4
5
6
Тестовые задания
Лабораторный опыт
§10. Гидролиз солей
1
2
3
Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Практическая работа 2
§12. Характеристика галогенов
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§13. Хлор
1
2
3
4
5
6
7
Тестовые задания
§14. Хлороводород: получение и свойства
1
2
3
§15. Соляная кислота и её соли
1
2
3
4
Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств
Практическая работа 3
§17. Характеристика кислорода и серы
1
2
3
4
Тестовые задания
Лабораторный опыт
§18. Свойства и применение серы
1
2
3
Тестовые задания
§19. Сероводород. Сульфиды
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота
1
2
4
Тестовые задания
Лабораторный опыт
§21. Оксид серы(VI). Серная кислота
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота
1
2
3
§24. Аммиак
1
2
3
Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств
Практическая работа 5
§26. Соли аммония
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§27. Азотная кислота
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты
1
2
3
§29. Фосфор
1
2
3
4
Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли
1
2
3
4
§31. Характеристика углерода и кремния. Аллотропия углерода
1
2
3
§32. Химические свойства углерода. Адсорбция
1
2
3
4
5
6
7
Тестовые задания
§33. Оксид углерода(II) — угарный газ
1
2
3
Тестовые задания
§34. Оксид углерода(IV) — углекислый газ
1
2
3
4
Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе
1
2
3
4
5
6
7
Тестовые задания
Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Практическая работа 6
§37. Кремний. Оксид кремния(IV)
1
2
3
Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент
1
2
3
4
§39. Характеристика металлов
1
2
3
4
5
6
Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения
1
2
3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов
1
2
3
Лабораторный опыт
§42. Сплавы
1
2
3
§43. Щелочные металлы
1
2
3
4
5
6
Тестовые задания
§44. Магний. Щелочноземельные металлы
1
2
3
4
5
Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий
1
2
3
4
5
6
7
8
Тестовые задания
§47. Важнейшие соединения алюминия
1
2
3
4
5
Лабораторный опыт
§48. Железо
1
2
3
4
Тестовые задания
§49. Соединения железа
1
2
3
4
Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»
Практическая работа 7
§51. Органическая химия
1
2
3
4
5
6
Тестовые задания
§52. Предельные (насыщенные) углеводороды
1
2
3
4
Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды
1
2
3
4
5
§54. Полимеры
1
2
§55. Производные углеводородов. Спирты
1
2
3
Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры
1
2
3
4
5
6
Тестовые задания
§57. Углеводы
1
2
3
§58. Аминокислоты. Белки
1
2
3
4
5
Задания
§1. Окислительно-восстановительные реакции
1
2
3
4
5
6
Тестовые задания
§2. Тепловые эффекты химических реакций
2
3
4
§3. Скорость химических реакций
1
2
3
4
Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии
2
3
Тестовые задания
§6. Сущность процесса электролитической диссоциации
1
2
3
4
§7. Диссоциация кислот, оснований и солей
1
2
3
Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации
1
2
3
4
Тестовые задания
§9. Реакции ионного обмена
1
2
3
4
5
6
Тестовые задания
Лабораторный опыт
§10. Гидролиз солей
1
2
3
Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Практическая работа 2
§12. Характеристика галогенов
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§13. Хлор
1
2
3
4
5
6
7
Тестовые задания
§14. Хлороводород: получение и свойства
1
2
3
§15. Соляная кислота и её соли
1
2
3
4
Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств
Практическая работа 3
§17. Характеристика кислорода и серы
1
2
3
4
Тестовые задания
Лабораторный опыт
§18. Свойства и применение серы
1
2
3
Тестовые задания
§19. Сероводород. Сульфиды
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота
1
2
4
Тестовые задания
Лабораторный опыт
§21. Оксид серы(VI). Серная кислота
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота
1
2
3
§24. Аммиак
1
2
3
Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств
Практическая работа 5
§26. Соли аммония
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§27. Азотная кислота
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты
1
2
3
§29. Фосфор
1
2
3
4
Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли
1
2
3
4
§31. Характеристика углерода и кремния. Аллотропия углерода
1
2
3
§32. Химические свойства углерода. Адсорбция
1
2
3
4
5
6
7
Тестовые задания
§33. Оксид углерода(II) — угарный газ
1
2
3
Тестовые задания
§34. Оксид углерода(IV) — углекислый газ
1
2
3
4
Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе
1
2
3
4
5
6
7
Тестовые задания
Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Практическая работа 6
§37. Кремний. Оксид кремния(IV)
1
2
3
Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент
1
2
3
4
§39. Характеристика металлов
1
2
3
4
5
6
Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения
1
2
3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов
1
2
3
Лабораторный опыт
§42. Сплавы
1
2
3
§43. Щелочные металлы
1
2
3
4
5
6
Тестовые задания
§44. Магний. Щелочноземельные металлы
1
2
3
4
5
Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий
1
2
3
4
5
6
7
8
Тестовые задания
§47. Важнейшие соединения алюминия
1
2
3
4
5
Лабораторный опыт
§48. Железо
1
2
3
4
Тестовые задания
§49. Соединения железа
1
2
3
4
Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»
Практическая работа 7
§51. Органическая химия
1
2
3
4
5
6
Тестовые задания
§52. Предельные (насыщенные) углеводороды
1
2
3
4
Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды
1
2
3
4
5
§54. Полимеры
1
2
§55. Производные углеводородов. Спирты
1
2
3
Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры
1
2
3
4
5
6
Тестовые задания
§57. Углеводы
1
2
3
§58. Аминокислоты. Белки
1
2
3
4
5
Самостоятельная работа с ответами к учебнику Г.Е. Рудзитис
Практическая работа №1. Изучение влияния условий проведения реакции на её скорость
Выберите верный вариант ответа
Вопрос 1. Какое вещество в опытах используется в виде гранул?
цинк мел соляная кислота вода
Вопрос 2. С каким из металлов не взаимодействует соляная кислота?
цинк медь алюминий магний
Вопрос 3. В каком виде мел быстрее реагирует с кислотой?
мел, растворенный в воде небольшой кусочек мелкий порошок стандартный размер школьного мела
Вопрос 4. Какой признак реакции наблюдается при взаимодействии металлов с кислотами?
выделение газа образование осадка изменение цвета вещества разложение вещества на составные части
Вопрос 5. Какое вещество используется для ускорения разложения пероксида водорода?
оксид марганца поваренная соль вода соляная кислота
Вопрос 6. Какой объем кислоты быстрее прореагирует с мелом при одинаковой концентрации?
1 миллилитр 1 грамм 1 моль 1 литр
Вопрос 7. При какой концентрации кислоты образование водорода будет происходить быстрее?
10% 30% 15% 25%
Вопрос 8. Какая лучинка используется для определения кислорода?
вырезанная из древесины лиственных пород деревьев хорошо высушенная тлеющая обработанная специальным составом
Вопрос 9. Какая из кислот в растворах не взаимодействует с металлами?
азотная кремниевая угольная серная
Отметьте верные утверждения
Температура не влияет на скорость реакции Природа реагирующих веществ не влияет на скорость химических реакций Все кислоты реагируют с металлами с одинаковой скоростью При разложении пероксида водорода образуется вода и газообразный кислород Площадь поверхности соприкосновения веществ не влияет на скорость реакций Изменение условий не влияет на скорость химических реакций Все катализаторы одинаково влияют на все химические реакции В горячей воде скорость реакции выше, чем в холодной Концентрация оказывает влияния на скорость реакцииОтметьте верные варианты ответов !Правильные ответы доступны при прохождении теста на сайте !
Основные понятия
Под химической реакцией понимают процесс превращения одних веществ в другие. При этом, происходит передача электронов или образование новых связей. Каждое химическое взаимодействие характеризуется специфическими параметрами, характеризующими сами реактивы, условия проведения и химические преобразования. От всех этих факторов зависит внешний вид реакционной массы.
- Вещества, которые вступают в химическую реакцию, называются исходными, а образующие в результате нее – продукты.
- Исходя из преобразований молекул выделяют типы химических реакций: соединение, расщепление, замещение, обмен. Есть более сложные варианты: полимеризация, комплексообразование, перенос.
- В любой реакции происходит изменение энергетических состояний молекул. В одних случаях требуется затрата энергии на разрыв молекулярных связей – эндотермические реакции, в других – энергия выделяется сама из-за ее высвобождения – экзотермические процессы.
- Вещества могут находиться в разных агрегатных состояниях – жидком, твердом, газообразном. Также, в процессе химического взаимодействия может происходить смена агрегатного состояния.
Все эти факторы формируют параметры химического процесса: признаки, скорость, обратимость и т.д.
Признаки химических реакций
Проведем несколько химических реакций. Нагреем в пробирке зеленый порошок малахита (рис. 53) — минерала, в состав которого входят атомы меди, углерода, водорода и кислорода. Порошок малахита начинает «кипеть» из-за выделяющегося газа. Поднесем к отверстию пробирки спичку, она гаснет — это выделяющийся углекислый газ препятствует ее горению. На стенках пробирки заметны капельки воды, на дне остается черный порошок соединения меди (CuO). Наблюдения доказывают, что образуются новые вещества с другими свойствами. Прекратим нагревание. Сразу прекращается выделение углекислого газа — реакция больше не протекает.
Существуют и другие признаки химических реакций. Например, при горении магния излучается яркий свет и выделяется много теплоты (см. рис. 50).
Раньше вспышка магния использовалась для освещения объекта во время фотографирования.
При сливании некоторых растворов наблюдается выпадение осадка (рис. 54). Некоторые осадки можно растворить при помощи других веществ. Например, при сливании растворов соды и известковой воды образуется белый осадок, который легко растворяется в уксусе.
При сгорании спички ощущается резкий запах. Какие еще признаки химических реакций наблюдаются при горении спички?
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Признаки химических реакций: • Выделение газа. • Образование или исчезновение осадка. • Изменение цвета. • Появление запаха. • Излучение света. • Выделение или поглощение теплоты.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Физические явления
Нальем воду в колбу и нагреем ее до кипения. Каждый из вас знает, что при кипении вода превращается в пар, т. е. переходит в другое агрегатное состояние. Однако несложно доказать, что вода и пар — это одно и то же вещество. Подумайте, как это можно сделать.
Нагреем тонкую стеклянную трубку в пламени спиртовки. Стекло станет мягким, и мы легко изменим форму трубки, но стекло как вещество остается тем же.
Эти явления физические. При физических явлениях не происходит образования новых веществ. Изменяется только агрегатное состояние веществ, их форма, а состав веществ остается прежним (рис. 48).
Например, вода — это вещество, которое в природе образует не только реки, моря, но и ледники, и облака. Ледники тают, облака роняют капли воды, вода испаряется, т. е. происходит изменение ее агрегатного состояния, но состав молекул остается неизменным.
Сгибание проволоки, дробление соли, плавление металлов (рис. 49), образование мраморной крошки, перемалывание зерна в муку, превращение воды в пар при кипячении — все это физические явления. Они осуществляются в результате деятельности человека. У веществ при этом изменяется только форма или агрегатное состояние.
Физическими называются явления, при которых изменяется только форма или агрегатное состояние веществ.
ГДЗ — лучшее решение проблем
Химия пригодится ученикам как для получения многих профессий, так и для решения бытовых вопросов. Это изначально кажется, что знать непростые соединения и вещества в принципе не обязательно, ведь у ребят нет осознания того, зачем именно они все это учат. Таким образом могут возникнуть многочисленные пробелы, которые помешают правильно воспринимать последующий материал. Решебник к учебнику по химии за 9 класс Рудзитис Г.Е., Фельдман Ф.Г. (ФГОС) позволит быстро и качественно освоить предмет.
Используя справочник для систематических занятий, ученики получат возможность:
- улучшить качество домашних заданий;
- своевременно находить и устранять ошибки;
- тщательно разбирать непонятные темы;
- заранее готовиться к многочисленным проверочным испытаниям.
Работать с решебником подростки могут в удобном для себя темпе, так как издание доступно онлайн и открыть его легко с любого гаджета, подключенного к Интернету. Уделяя тренировкам хотя бы несколько минут в день, отстающие от программы учащиеся не только нагонят одноклассников, но и продвинутся вперед, что обеспечит им хорошие оценки и похвалу учителя.





























