Пройти практику можно с ГДЗ к учебнику Габриеляна
Химия нравится многим школьникам, так как на уроках учителя показывают много увлекательных и интересных опытов. Да и в целом эта наука способна по-настоящему увлечь. Конечно, трудности неизбежны, особенно при решении уравнений. Поэтому ученикам нужно запоминать все формулы, иначе они рискуют наделать много ошибок. Решебник Габриеляна по химии 9 класс, написанный в соответствии с ФГОС, позволит разобраться во всех непонятных темах и хорошо усвоить новую информацию.
Благодаря сведениям, почерпнутым из справочника, учащиеся получают возможность:
- научиться правильно решать сложные задачи;
- без ошибок выполнять самые обширные домашние задания;
- дополнительно тренироваться для отработки практики;
- выявлять свои слабые места.
Практические номера имеют важное значение для понимания теоретических законов химии. Подростки учатся находить основу химических явлений, основываясь на сделанных расчетах
Стоит допустить ошибку, как простая реакция может обернуться глобальным взрывом, способным уничтожить всю планету. С помощью решебника девятиклассники точно поймут когда и какие действия они должны совершать, чтобы добиться нужного результата.
§ 45. Строение и физические свойства аминов
Строение молекулы аммиака и иона аммония. Донорно-акцепторная связь
Формула аммиака — NH3. Рассмотрим, как образуются ковалентные связи в молекуле аммиака. На внешнем электронном слое атома азота имеется три неспаренных электрона:
В атоме водорода — один неспаренный электрон:
Тогда схему образования ковалентных связей в молекуле аммиака можно представить следующим образом:
Из схемы видно, что три неспаренных электрона атома азота участвуют в образовании трёх ковалентных связей N—H. В то же время на внешнем слое атома азота остаётся электронная пара. Такая электронная пара называется неподелённой электронной парой. Структурная формула аммиака:Благодаря наличию неподелённой электронной пары атом азота молекулы аммиака может образовать ещё одну ковалентную связь. Например, молекула аммиака способна присоединять катион водорода H+, образуя ион аммония: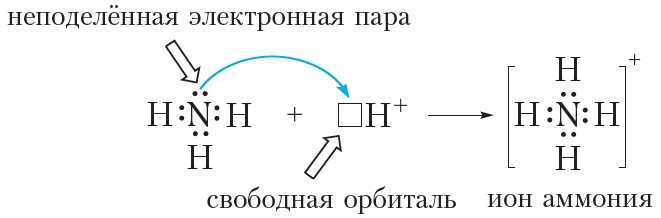
или
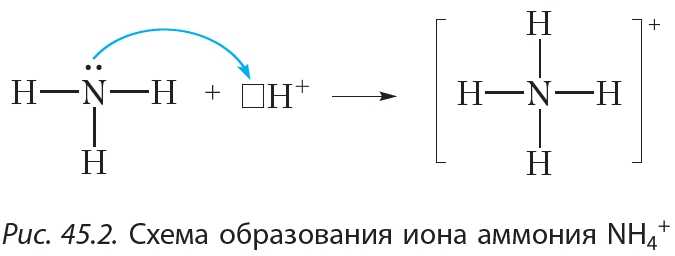
Из рисунка 45.2 видно, что все четыре ковалентные связи N—H в ионе аммония одинаковы. Они образованы посредством общих электронных пар между атомами азота и водорода. Однако механизм образования этих связей различается. Три связи N—H образуются за счёт неспаренных электронов атомов азота и водорода (рис. 45.1). Такой способ образования ковалентной связи называется обменным. Четвёртая связь N—H в ионе аммония образуется за счёт неподелённой электронной пары атома азота и свободной орбитали катиона H+ (рис. 45.2). Такой способ образования ковалентной связи называется донорно-акцепторным. При этом атом азота, предоставляющий электронную пару, называется донором, а катион водорода, принимающий электронную пару на свою свободную орбиталь, — акцептором.
Вещества, способные присоединять катион водорода H+, являются основаниями. Следовательно, аммиак — основание. Оснóвные свойства аммиака проявляются в реакциях с кислотами. В этих реакциях образуются соли аммония: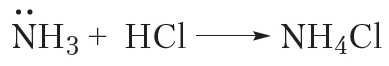
или
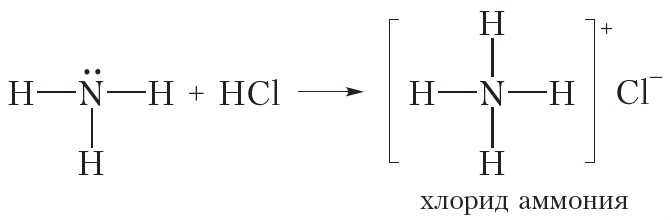
Видно, что в реакции с HCl молекула NH3 присоединяет катион H+ и превращается в ион аммония NH4+. В ионе аммония атом азота образует четыре ковалентные связи N—H, поэтому валентность азота равна IV. В хлориде аммония кроме ковалентных связей N—H имеется ионная связь между катионом NH+ и анионом Cl–.
Аммиак проявляет оснóвные свойства не только при взаимодействии с кислотами, но и с водой. Так, при растворении аммиака в воде протекает обратимая реакция: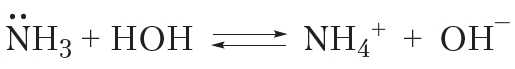
или
Видно, что при взаимодействии с водой молекула аммиака присоединяет катион водорода. При этом образуются ион аммония NH+ и гидроксид-ион OH–. Наличие ионов OH– обусловливает щелочную реакцию водных растворов аммиака.
Перейдём к рассмотрению строения органических азотсодержащих веществ — аминов.
Преимущества ГДЗ
В отличие от основного учебника, в онлайн-справочнике подробно описывается каждая тема, а также приведено больше ярких примеров. Но эти две книги дополняют друг друга. Без них невозможно хорошенько подготовиться к какому-либо испытанию. «ГДЗ по химии за 9 класс Габриелян О. С. (Дрофа)» обладает целым рядом плюсов. Во-первых, сборник решенных заданий и правильных ответов находится в электронном доступе. Во-вторых, благодаря ему можно научиться применять полученные знания в деле. А этот ценный навык пригодится не только при выполнении домашних заданий, но и при изучении остальных школьных дисциплин. В-третьих, справочником могут воспользоваться ребята с любым уровнем подготовки.
§ 42. По теме: Характерные химические свойства неорганических веществ. Вопросы к §
§ 2. По теме: Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды. Лабораторный опыт§ 3. По теме: Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Лабораторный опыт
§ 6. По теме: Катализаторы и катализ. Лабораторный опыт
№9 №10 №11§ 11. По теме: Химические свойства металлов. Лабораторный опыт§ 12. По теме: Получение металлов. Лабораторный опыт§ 14. По теме: Щелочные металлы. Лабораторный опыт§ 15. По теме: Бериллий, магний и щелочноземельные металлы. Лабораторный опыт§ 16. По теме: Алюминий. Лабораторный опыт
§ 21. По теме: Вода в жизни человека. Лабораторный опыт
№24 №25§ 23. По теме: Соединения галогенов. Лабораторный опыт§ 25. По теме: Кислород. Лабораторный опыт§ 26. По теме: Сера. Лабораторный опыт§ 27. По теме: Соединения серы. Лабораторный опыт§ 29. По теме: Аммиак. Лабораторный опыт§ 30. По теме: Соли аммония. Лабораторный опыт
Влияет ли решебник на оценки?
Уроки по предмету, хоть и важны, но на них в школе отводится очень мало времени. Как правило, это 1-2 часа в неделю. При этом объемы и сложность информации, которую нужно понять и запомнить весьма велики. Так что порой без помощи ребятам бывает очень трудно справиться с полученными заданиями. Поэтому использование сборника ответов по химии для 9 класса автор Габриелян (ФГОС) можно считать не просто прихотью ленивых учеников, а насущной необходимостью для каждого школьника.
Применяя пособие для систематических занятий, подростки:
- лучше разберутся в дисциплине;
- поднимут успеваемость по предмету;
- станут добиваться хороших оценок по тестированиям;
- не будут зависеть от помощи со стороны.
В издании есть все необходимое, от верных ответов до дополнительных комментариев авторов, что позволит досконально освоить учебный материал самостоятельно. Но имеются и свои нюансы при работе с решебником. Если просто списывать из него готовые решения, то пользы это не принесет. Только анализ выполненных д/з и тщательный разбор всех приведенных в сборнике сведений поможет приобрести необходимые знания.






























