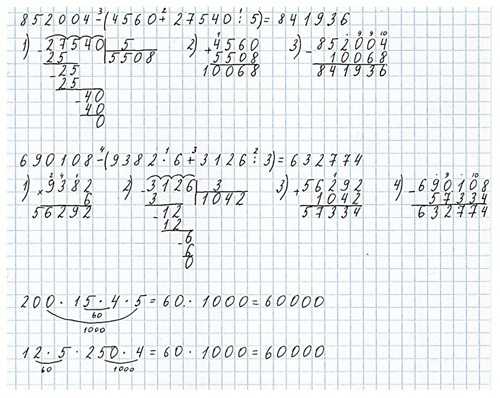Что узнали. Чему научились
Номер 1.
Объясни приём вычисления.
18 ∙ 20 = 18 ∙ (2 ∙ 10) = (18 ∙ 2) ∙ 10 = 36 ∙ 10 = 360
25 ∙ 12 = 25 ∙ (4 ∙ 3) = (25 ∙ 4) ∙ 3 = 100 ∙ 3 = 300
Ответ:
Перестановка и группировка множителей.
Номер 2.
Закончи решение.
Ответ:
1) 35 ∙ 20 = 35 ∙ (2 ∙ 10) = (35 ∙ 2) ∙ 10 = 700
25 ∙ 24 = 25 ∙ (4 ∙ 6) = (25 ∙ 4) ∙ 6 = 600
2) 16 ∙ 30 = 16 ∙ (3 ∙ 10) = (16 ∙ 3) ∙ 10 = 480
42 ∙ 20 = 42 ∙ (2 ∙ 10) = (42 ∙ 2) ∙ 10 = 840
12 ∙ 40 = 12 ∙ (4 ∙ 10) = ( 12 ∙ 4) ∙ 10 = 480
25 ∙ 16 = 5 ∙ 5 ∙ 2 ∙ 8 = (5 ∙ 2) ∙ (5 ∙ ![]() = 10 ∙ 40 = 400
= 10 ∙ 40 = 400
15 ∙ 18 = 3 ∙ 5 ∙ 2 ∙ 9 = (5 ∙ 2) ∙ (3 ∙ 9) = 10 ∙ 27 = 270
45 ∙ 14 = 9 ∙ 5 ∙ 2 ∙ 7 = (5 ∙ 2) ∙ (9 ∙ 7) = 10 ∙ 63 = 630
13 ∙ 60 = 13 ∙ (6 ∙ 10) = (13 ∙ 6) ∙ 10 = 780
45 ∙ 20 = 45 ∙ (2 ∙ 10) = (45 ∙ 2) ∙ 10 = 900
15 ∙ 30 = 15 ∙ (3 ∙ 10) = (15 ∙ 3) ∙ 10 = 450
14 ∙ 50 = 2 ∙ 7 ∙ 5 ∙ 10 = (2 ∙ 5) ∙ (7 ∙ 10) = 700
Номер 3.
Сравни выражения и поставь знак >, < или =, чтобы получились верные записи.
Ответ:
18 ∙ 40 = 18 ∙ 4 ∙ 10
18 ∙ 40 = 18 ∙ 40
72 ∙ 14 < 72 ∙ 10 ∙ 4
72 ∙ 14 < 72 ∙ 40
36 ∙ 5 ∙ 10 > 36 ∙ 15
36 ∙ 50 > 36 ∙ 15
98 ∙ 21 = 98 ∙ 3 ∙ 7
98 ∙ 21 = 98 ∙ 21
Номер 4.
Для ремонта квартиры купили 8 рулонов обоев длиной по 10 м 50 см. После ремонта осталась одна четвёртая часть купленных обоев. Сколько метров обоев осталось? Сколькими способами можно решить задачу? Запиши каждое решение.
Ответ:
Задачу можно решить двумя способами.
Можно оформить в виде чертежа:
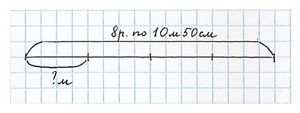
Способ решения 1:
Способ решения 2:
1) 10 м 50 см ∙ 8 = 84 (м) – было куплено обоев.
2) 84 : 4 = 21 (м) – обоев осталось.
1) 8 : 4 = 2 (р.) – обоев осталось после ремонта.
2) 10 м 50 см ∙ 2 = 21 (м) – обоев осталось после ремонта.
Ответ: 21 м.
Номер 5.
Школьная библиотека получила 290 новых учебников в одинаковых пачках. Учебников по русскому языку было 10 пачек, столько же пачек учебников по чтению и 9 пачек учебников по математике. Объясни, что показывают выражения.
Ответ:
290 : (10 + 10 + 9) = 10 – количество учебников в одной пачке.
290 : (10 + 10 + 9) ∙ 9 = 90 – количество учебников по математике.
Номер 6.
Ответ:
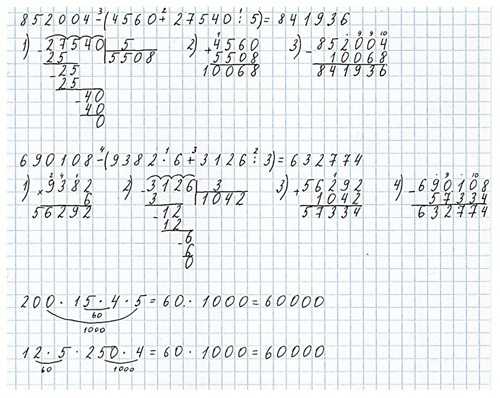
Номер 7.
Рассмотри таблицу и объясни, что обозначают выражения.
1) 30 : 5; 2) 400 : 100; 3) 100 : 5; 4) 100 − 5; 5) 30 : 5 + 400 : 100; 6) 30 : 5 − 400 : 200.
 Ответ:
Ответ:
1) Время движения первого объекта.
2) Время движения второго объекта.
3) Во сколько раз скорость второго объекта больше скорости первого.
4) На сколько км/ч скорость второго объекта больше скорости первого.
5) Общее время движения обоих объектов.
6) На сколько больше был в движении первый объект, чем второй.
Номер 8.
Выполни деление с остатком и проверку.
Ответ:
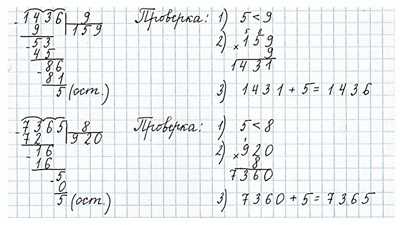

Номер 9.
Ответ:

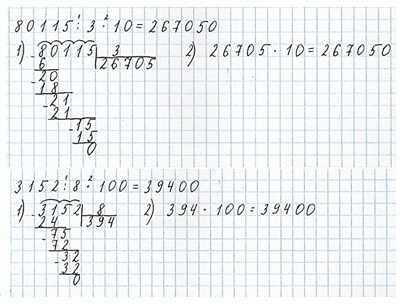
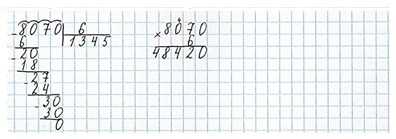
Задания на полях страницы
Ребус.
Ответ:
Реши. Найди лишнее уравнение.
Ответ:
х ∙ 8 = 56
х = 7
х ∙ 14 = 98
х = 7
84 : х = 12
х = 7
5 ∙ х = 35
х = 7
х ∙ 7 = 42
х = 6 – лишнее уравнение.
ГДЗ — лучшее решение проблем
Химия пригодится ученикам как для получения многих профессий, так и для решения бытовых вопросов. Это изначально кажется, что знать непростые соединения и вещества в принципе не обязательно, ведь у ребят нет осознания того, зачем именно они все это учат. Таким образом могут возникнуть многочисленные пробелы, которые помешают правильно воспринимать последующий материал. Решебник к учебнику по химии за 9 класс Рудзитис Г.Е., Фельдман Ф.Г. (ФГОС) позволит быстро и качественно освоить предмет.
Используя справочник для систематических занятий, ученики получат возможность:
- улучшить качество домашних заданий;
- своевременно находить и устранять ошибки;
- тщательно разбирать непонятные темы;
- заранее готовиться к многочисленным проверочным испытаниям.
Работать с решебником подростки могут в удобном для себя темпе, так как издание доступно онлайн и открыть его легко с любого гаджета, подключенного к Интернету. Уделяя тренировкам хотя бы несколько минут в день, отстающие от программы учащиеся не только нагонят одноклассников, но и продвинутся вперед, что обеспечит им хорошие оценки и похвалу учителя.
Задания
§1. Окислительно-восстановительные реакции
1
2
3
4
5
6
Тестовые задания
§2. Тепловые эффекты химических реакций
2
3
4
§3. Скорость химических реакций
1
2
3
4
Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии
2
3
Тестовые задания
§6. Сущность процесса электролитической диссоциации
1
2
3
4
§7. Диссоциация кислот, оснований и солей
1
2
3
Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации
1
2
3
4
Тестовые задания
§9. Реакции ионного обмена
1
2
3
4
5
6
Тестовые задания
Лабораторный опыт
§10. Гидролиз солей
1
2
3
Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Практическая работа 2
§12. Характеристика галогенов
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§13. Хлор
1
2
3
4
5
6
7
Тестовые задания
§14. Хлороводород: получение и свойства
1
2
3
§15. Соляная кислота и её соли
1
2
3
4
Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств
Практическая работа 3
§17. Характеристика кислорода и серы
1
2
3
4
Тестовые задания
Лабораторный опыт
§18. Свойства и применение серы
1
2
3
Тестовые задания
§19. Сероводород. Сульфиды
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота
1
2
4
Тестовые задания
Лабораторный опыт
§21. Оксид серы(VI). Серная кислота
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота
1
2
3
§24. Аммиак
1
2
3
Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств
Практическая работа 5
§26. Соли аммония
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§27. Азотная кислота
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты
1
2
3
§29. Фосфор
1
2
3
4
Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли
1
2
3
4
§31. Характеристика углерода и кремния. Аллотропия углерода
1
2
3
§32. Химические свойства углерода. Адсорбция
1
2
3
4
5
6
7
Тестовые задания
§33. Оксид углерода(II) — угарный газ
1
2
3
Тестовые задания
§34. Оксид углерода(IV) — углекислый газ
1
2
3
4
Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе
1
2
3
4
5
6
7
Тестовые задания
Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Практическая работа 6
§37. Кремний. Оксид кремния(IV)
1
2
3
Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент
1
2
3
4
§39. Характеристика металлов
1
2
3
4
5
6
Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения
1
2
3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов
1
2
3
Лабораторный опыт
§42. Сплавы
1
2
3
§43. Щелочные металлы
1
2
3
4
5
6
Тестовые задания
§44. Магний. Щелочноземельные металлы
1
2
3
4
5
Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий
1
2
3
4
5
6
7
8
Тестовые задания
§47. Важнейшие соединения алюминия
1
2
3
4
5
Лабораторный опыт
§48. Железо
1
2
3
4
Тестовые задания
§49. Соединения железа
1
2
3
4
Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»
Практическая работа 7
§51. Органическая химия
1
2
3
4
5
6
Тестовые задания
§52. Предельные (насыщенные) углеводороды
1
2
3
4
Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды
1
2
3
4
5
§54. Полимеры
1
2
§55. Производные углеводородов. Спирты
1
2
3
Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры
1
2
3
4
5
6
Тестовые задания
§57. Углеводы
1
2
3
§58. Аминокислоты. Белки
1
2
3
4
5