Содержание решебника
На страницах электронной книги можно найти следующее:
- подробное объяснение тем;
- исчерпывающие авторские комментарии;
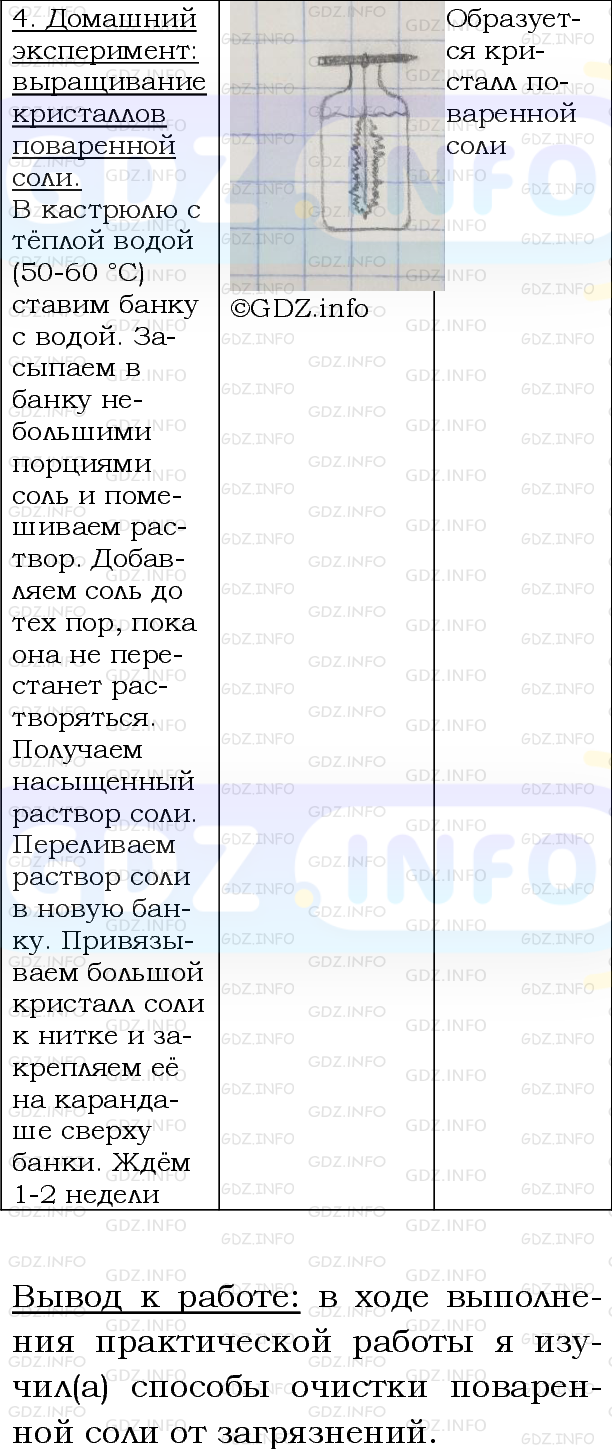
- заметки методистов;
- схемы, таблицы, рисунки;
- алгоритмы решения задач и уравнений;
- выполненные номера из тестов.
Некоторые ошибочно полагают, что в таком сборнике содержатся лишь верные ответы на вопросы в рамках программы. Но выше представленный список, содержащий в себе более ценную и важную информацию, должен изменить их мнение. Все сведения были неоднократно проверены авторами книги. Плюс ко всему изложены они простым и понятным для каждого пользователя языком.
Химия в 9 классе
Рабочая программа для нового учебного года была разработана, согласно всем строгим правилам и требованиям ФГОС, и направлена на изучение следующих тем:
- Закономерности изменения электроотрицательности элементов в группе и периоде.
- Состав атомных ядер. Изотопы.
- Схемы образования веществ с различным типом связи.
- Строение атома.
- Ионная связь.
- Степень окисления.
На протяжении всего учебного года преподаватели будут устраивать внеплановые проверки знаний, чтобы не только проследить за готовностью выпускников к урокам, но и подготовить их к самому важному в жизни испытанию. Благодаря таким тестам ученики сумеют выявить свои слабые места и подтянуть их с помощью данного учебно-вспомогательного комплекса
Задания
§1. Окислительно-восстановительные реакции
1
2
3
4
5
6
Тестовые задания
§2. Тепловые эффекты химических реакций
2
3
4
§3. Скорость химических реакций
1
2
3
4
Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии
2
3
Тестовые задания
§6. Сущность процесса электролитической диссоциации
1
2
3
4
§7. Диссоциация кислот, оснований и солей
1
2
3
Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации
1
2
3
4
Тестовые задания
§9. Реакции ионного обмена
1
2
3
4
5
6
Тестовые задания
Лабораторный опыт
§10. Гидролиз солей
1
2
3
Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Практическая работа 2
§12. Характеристика галогенов
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§13. Хлор
1
2
3
4
5
6
7
Тестовые задания
§14. Хлороводород: получение и свойства
1
2
3
§15. Соляная кислота и её соли
1
2
3
4
Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств
Практическая работа 3
§17. Характеристика кислорода и серы
1
2
3
4
Тестовые задания
Лабораторный опыт
§18. Свойства и применение серы
1
2
3
Тестовые задания
§19. Сероводород. Сульфиды
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота
1
2
4
Тестовые задания
Лабораторный опыт
§21. Оксид серы(VI). Серная кислота
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота
1
2
3
§24. Аммиак
1
2
3
Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств
Практическая работа 5
§26. Соли аммония
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§27. Азотная кислота
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты
1
2
3
§29. Фосфор
1
2
3
4
Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли
1
2
3
4
§31. Характеристика углерода и кремния. Аллотропия углерода
1
2
3
§32. Химические свойства углерода. Адсорбция
1
2
3
4
5
6
7
Тестовые задания
§33. Оксид углерода(II) — угарный газ
1
2
3
Тестовые задания
§34. Оксид углерода(IV) — углекислый газ
1
2
3
4
Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе
1
2
3
4
5
6
7
Тестовые задания
Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Практическая работа 6
§37. Кремний. Оксид кремния(IV)
1
2
3
Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент
1
2
3
4
§39. Характеристика металлов
1
2
3
4
5
6
Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения
1
2
3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов
1
2
3
Лабораторный опыт
§42. Сплавы
1
2
3
§43. Щелочные металлы
1
2
3
4
5
6
Тестовые задания
§44. Магний. Щелочноземельные металлы
1
2
3
4
5
Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий
1
2
3
4
5
6
7
8
Тестовые задания
§47. Важнейшие соединения алюминия
1
2
3
4
5
Лабораторный опыт
§48. Железо
1
2
3
4
Тестовые задания
§49. Соединения железа
1
2
3
4
Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»
Практическая работа 7
§51. Органическая химия
1
2
3
4
5
6
Тестовые задания
§52. Предельные (насыщенные) углеводороды
1
2
3
4
Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды
1
2
3
4
5
§54. Полимеры
1
2
§55. Производные углеводородов. Спирты
1
2
3
Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры
1
2
3
4
5
6
Тестовые задания
§57. Углеводы
1
2
3
§58. Аминокислоты. Белки
1
2
3
4
5
Практическая работа №9
Решение экспериментальных задач
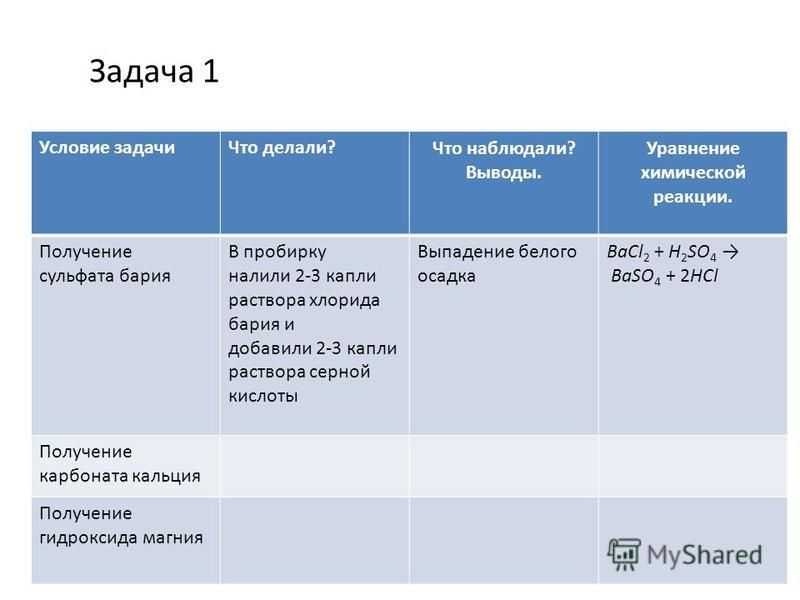
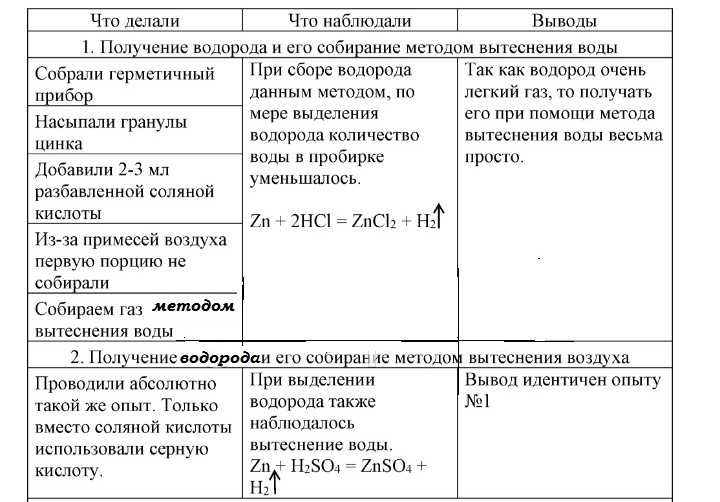
1.Цинк растворяется в концентрированной кислоте с выделением газа. Влажная универсальная индикаторная бумажка у горлышка пробирки краснеет — этот газ не водород.
Вывод: в данной реакции выделяется сернистый газ; окислителем является сера.
Получаем белый осадок нерастворимого гидроксида магния с выделением сероводорода с характерным запахом “тухлых яиц”
Вывод: реакции между данными веществами идут только в случае получения осадка или выделения газа; полученный гидроксид и нерастворимые соли магния- белого цвета.
3. Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты; г) сульфита натрия и серной кислоты; д) сульфата меди (II) и азотной кислоты.
Слейте попарно эти растворы, слегка нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Напишите уравнения в молекулярном и ионном виде
Реакция идет с выделением газа без цвета и запаха. Когда подносим горящую лучинку к горлышку пробирки, лучинка гаснет. Это- углекислый газ.
Реакция идет с выделением газа с характерным запахом “тухлых яиц”.
Это — сероводород.
Реакция идет с выделением газа с характерным запахом “сгоревших спичек”.
Это — сернистый газ.
Реакции нет, т.к. не образуется конечных продуктов
Вывод: реакции между данными веществами идут только в случае выделения газа.
Реакция идет с небольшим подогревом.
Выделяется газ без цвета и запаха. Когда подносим горящую лучинку к горлышку пробирки, лучинка гаснет.
Это — углекислый газ.
Железо выталкивает медь из сульфата, т.к. является более активным металлом; происходит реакция замещения, чистая медь оседает на железной пластинке.
Алюминий растворяется, выделяется газ. Если поднести лучинку к пробирке, слышен хлопок- микровзрыв водорода и кислорода.
Газ — водород.
Алюминий- восстановитель, водород- окислитель.
г) Медь растворяется в концентрированной кислоте, раствор становится голубым, выделяется газ. Влажная универсальная индикаторная бумажка у горлышка пробирки краснеет- этот газ не водород.
Медь- восстановитель, сера- окислитель.
6. Пользуясь растворами и веществами, получите вещества. Составьте молекулярные и ионные уравнения.
а) гидроксид железа (III)
Получаем черный с “теплым” оттенком осадок сульфида меди (II).
в) оксид серы (IV)
Медь растворяется в концентрированной кислоте, раствор становится голубым, выделяется газ. Влажная универсальная индикаторная бумажка у горлышка пробирки краснеет- этот газ не водород.
Получаем плотный белый осадок нерастворимого карбоната магния в виде суспензии.
д) свинец
ЭТАП 1. Термическое разложение нитрата свинца (II)
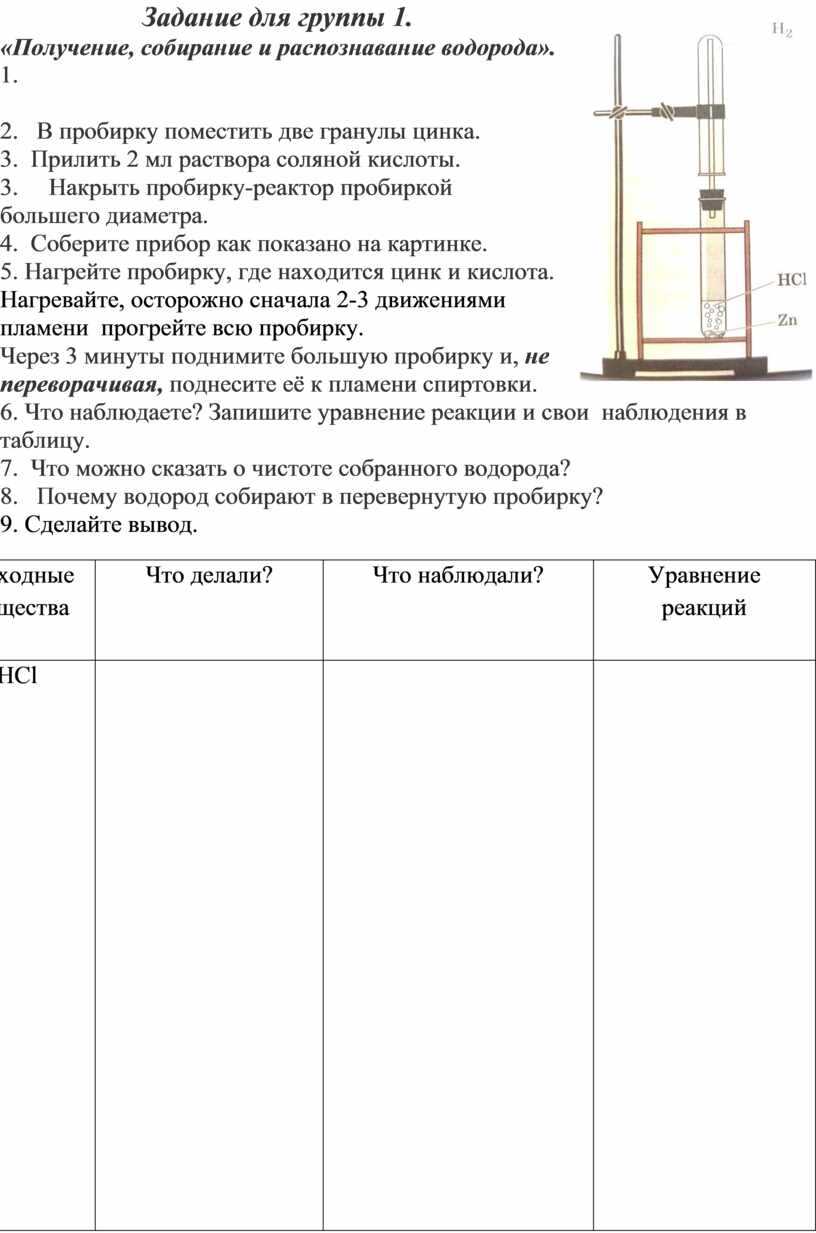
В центральный шар насыпаем гранулы цинка. Сверху через воронку наливаем раствор соляной кислоты. Открываем кран, соляная кислоты заполняет нижнее полушарие, поднимается к центральному; и реакция начинается:
Собираем водород в перевернутую вверх дном пробирку (методом вытеснения воздуха).
Проверка на чистоту — пронести пробирку над спиртовкой. Если водород чистый, раздается характерный хлопок микровзрыва.
ЭТАП 3. Получение чистого свинца
Шаг 4: Потушите пламя и развейте пепел.
Потушить пламя
- По окончании церемонии все присутствующие направляются к зданию морга, чтобы потушить пламя.
- Тем временем доверенное лицо выключает световую палочку, также известную как «свет памяти», которая использовалась для освещения церемонии.
- Семьи также могут разместить личные вещи, символизирующие дружбу и любовь, внутри здания морга, прежде чем пламя погаснет.
Развеять пепел
- Как только пламя погаснет, семьи смогут развеять пепел.
- Если семья решит развеять прах в море, панихида отправится в этот район на лодке. По прибытии священник или бортпроводники проведут церемонию, которая может включать песни, речи или чтения в память об умершем.
- В конце церемонии семьи бросают пепел в воду, где он естественным образом вымирает навсегда.
Отдать дань уважения
- Семьи могут продлить обряд развеивания праха, делая осмысленные жесты, чтобы отдать дань уважения своему умершему ангелу.
- Эти жесты могут включать восхваление умершего во время церемонии, празднование или подношение его духу, а также произнесение «слов света», чтобы пробудить воспоминания об умершем.
- Когда празднуется душа умершего, семьи могут собраться вместе и поделиться воспоминаниями об умершем, что помогает им обрести завершенность.
В заключение этой статьи о том, как сжигать порошкообразную серу, важно помнить, что существуют различные методы достижения этой цели. Вы можете использовать нетрадиционные методы, такие как смешивание растительных масел и серы или вариант сжигания на открытом воздухе, или вы можете выбрать более распространенные методы, такие как использование бензиновой горелки
Какой бы процесс ни был выбран, необходимо тщательно учитывать размер топлива и температуру огня, чтобы конечный продукт был удовлетворительным.
§25. Практическая работа 3. Получение и свойства кислорода
1. Получение и собирание кислородаа) Соберите прибор, как показано на рисунке 25 (с. 73). и проверьте его на герметичность. В пробирку насыпьте перманганат калия примерно на 1/4 её объёма и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Закрепите пробирку на лапке штатива гак, чтобы конец газоотводной трубки почти доходил до дна стакана или цилиндра, и которой будет собираться кислород.В пламени спиртовки сначала обогрейте всю пробирку, а затем нагревайте ее дно.Полноту заполнения стакана (цилиндра) кислородом проверяйте тлеющей лучинкой. Как только сосуд наполнится кислородом, закройте его картоном или стеклянной пластинкой.б) Соберите прибор, как показано на рисунке 26 (с. 74), и проверьте его на герметичность. В сосуд с водой опрокиньте пробирку с водой (или цилиндр, закрытый стеклянной пластинкой). Затем пробирку (цилиндр) с водой наденьте на конец газоотводной трубки и шире войте пробирку с перманганатом калия. Когда сосуд заполнится кислородом, закройте его под водой стеклянной пластинкой.2. Горение в кислороде угля и серыа) Положите в железную ложечку кусочек древесного угля и раскалите его в пламени спиртовки. Затем ложечку с тлеющим углем внесите в сосуд с кислородом и наблюдайте за происходящим. Когда горение прекратится, налейте в сосуд немного известковой воды и взболтайте. Почему известковая вода мутнеет’ Запишите уравнение реакции горения угля.б) В железную ложечку положите кусочек серы и подожгите ее в пламени спиртовки. (Опыт провозится в вытяжном шкафу!) Понаблюдайте, как сера горит на воздухе. Затем поместите горящую серу в сосуд с кислородом. Как изменилось пламя? Почему? Запишите уравнение реакции горения серы.3. Отчёт о работе оформите в виде таблицы (см. § 5).
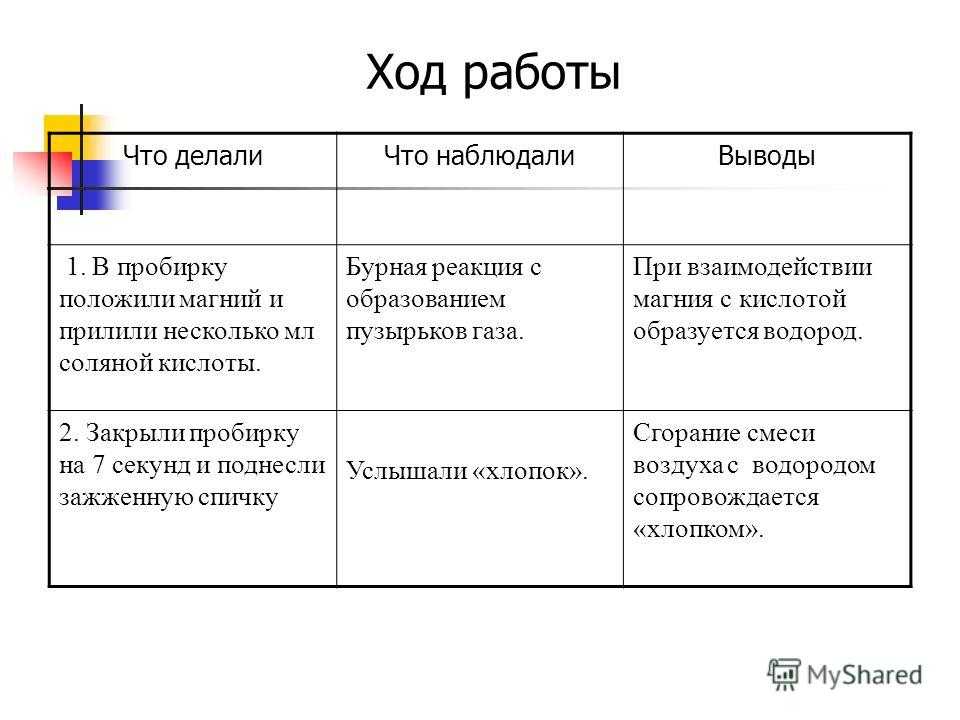
Что делалиСобрали установку как на рисунке, полноту заполнения стакана кислородом проверяли, вводя в него тлеющую лучинку.Собрали установку как на рисунке, методом вытеснения воды наполнили пробирку кислородом.Раскалили в пламени спиртовки древесный уголь, внесли его в пробирку с кислородом. Затем наполнили пробирку известковой водой и взболтали.Подожгли кусочек серы в пламени спиртовки. Затем внесли серу в пробирку с кислородом.
Что наблюдалиЧерез некоторое время после начала реакции тлеющая лучина, введенная в стакан, загоралась.По мере образования кислорода уровень воды в пробирке опускался.Уголь горит в кислороде. Известковая вода помутнела.Сера горит на воздухе медленно, в кислороде – интенсивно, синим пламенем. При этом появляется резкий запах.
ВыводыПолучить кислород в лаборатории можно разложением перманганата калия : О выделении кислорода можно судить по воспламеняющейся лучине (кислород поддерживает горение).Кислород – газ, поэтому с увеличением его концентрации в пробирке возрастает давление, в результате чего, кислород вытесняет воду, наполняя пробирку.Уголь горит в кислороде с образованием углекислого газа.Помутнение известковой воды – качественная реакция на углекислый газ, что подтверждает, что горение угля происходит согласно этому уравнению реакции.В воздухе концентрация кислорода небольшая – всего 21%. Поэтому сера горит в чистом кислороде гораздо интенсивнее.Появление резкого запаха свидетельствует об образовании оксида серы (IV) в процессе горения серы в кислороде.
-
Назад
-
Вперед
Шаг 3: зажгите порошок серы.
Зажгите серный порошок
Существует несколько способов разжигания порошка серы, в зависимости от условий и имеющихся у вас инструментов.
- Подожгите порошок серы спичкой.
- Положите два-четыре зерна порошка серы на плоскую поверхность.
- Используйте спичку, чтобы начать горение.
- Быстро отойдите от того места, где вы зажгли порошок серы.
- Подожгите порошок серы пламенем
- Поместите горящую палку на порошок серы.
- Оставьте палку горящей до тех пор, пока порошок серы не начнет гореть.
- Уберите горящую палку и уходите.
- Allumage на расстоянии
- Поместите порошок серы туда, где его нужно зажечь.
- Смешайте порошок серы с черным порошком.
- Используйте фитиль, чтобы зажечь порошок серы на расстоянии.
После зажигания серного порошка всегда обращайтесь к Руководство пользователя Keystone RV Company чтобы убедиться, что вы выполняете надлежащий процесс обеспечения безопасности. Если у вас есть какие-либо вопросы или сомнения, вы можете обратиться к НМД – Руководство оператора для получения дополнительной информации.
Шаг 1: Приготовьте порошок серы.
Способ получения серы
- Соберите необходимое количество сульфидной железной руды. Возможными источниками являются серная кислота, пиритовая порода, пирротин и галенит.
- Измельчите руду в очень мелкий порошок.
- Поместите измельченную руду в инертный металлический контейнер.
- Руду окунают в смесь серной кислоты и марганцевого сульфида, соблюдая установленные пропорции.
- Всыпьте активированный уголь, гидроксид калия и глет.
- Перемешайте содержимое, добавьте метанол до образования жидкой пасты.
- При необходимости используйте сильно хлорированный воздух.
- Выщелачивание окисляет руду с выделением серы в виде элементарной серы.
Очистка и подготовка
- Отфильтруйте суспензию, чтобы отделить твердые частицы от жидкости, и соберите жидкость.
- Кроме того, если в вашем процессе выщелачивания используются углеводороды (такие как алканы, алкены, спирты и их различные эфиры, альдегиды и т. д.), перегоняйте их для отделения фильтрата.
- На этом этапе удаляются все углеводороды и другие примеси, а также гарантируется стабильная кристаллическая структура без побочных продуктов элементарной серы.
- Теперь возьмите чистую жидкость и поместите ее в вакуумное испарение.
Изоляция из серного порошка
- Добавьте высушенные вещества в горячую чистую серную кислоту и перемешивайте до восстановления растворения.
- Профильтруйте жидкость до получения черного осадка.
- Промойте осадок метанолом при низком давлении и высушите его, получив желто-коричневый осадок: порошок серы.
- При обращении с химическими и физическими веществами на этих этапах обязательно надевайте соответствующие средства защиты глаз и перчатки.
- Это и безопасно, и гигиенично.
ответ:
Формы и письма для суда: Независимо от того, являетесь ли вы представителем заявителя или нет, вам необходимо будет заполнить формы, отправить их и понять их. Может быть сложно разобраться во всех документах, необходимых для их правильной подачи.
Процесс апелляции: Юридическое обращение в TSS — сложный процесс. Для этого вам необходимо знать все процессы, определить этапы, написать свои аргументы и предоставить юридические ссылки, а также соответствующие источники.
Юридические ресурсы: Непредставленные члены могут не обладать необходимыми навыками для решения определенных юридических исключительностей. Кроме того, поиск правовых источников и информации иногда может быть сложным.
- Местные ассоциации часто предлагают доступные или бесплатные юридические услуги.
- Существуют онлайн-ресурсы, книги и базы данных, содержащие юридическую и судебную информацию.
- Университеты часто предлагают семинары и мастер-классы по юридическим вопросам.
Шаг 2. Подготовьте место ожога.
Материалы
Вторым шагом в подготовке к обустройству места ожога является сбор необходимых материалов. Сюда входят любые легковоспламеняющиеся или горючие материалы, которые вам понадобятся для тушения огня, в том числе:
- Сухая или зеленая древесина
- Солома, кора и древесная кора
- Обработанные материалы и нетвердые топливные продукты, такие как твердое топливо, мазут и спирт.
- Горючие материалы для разжигания пожара
Безопасность и защита
Как только огонь зажжется, примите меры, чтобы обеспечить безопасность и защиту вашего объекта
Установка зоны безопасности имеет важное значение, чтобы гарантировать, что пламя не выйдет наружу и не причинит вреда людям или имуществу. Вам также необходимо будет принять меры, чтобы дым и газы, образующиеся в результате пожара, оставались в пределах безопасной зоны и не распространялись на окружающую территорию
Законодательство и нормативные стандарты
Убедитесь, что вы соблюдаете законодательные и нормативные требования, действующие на месте ожога. Вам необходимо будет учитывать экологические нормы в вашем регионе, а также правила защиты почвы и воздуха. Вы также должны соблюдать законы и правила, регулирующие защиту от падения, опасные продукты и опасные вещества, идентификацию и классификацию продуктов (WMIS) и другие требования. Примите меры для обеспечения наличия компетентных работников для выполнения работы и принятия всех соответствующих мер безопасности.
Практическая работа по химии на тему «Получение, собирание и распознавание кислорода»
Практическая работа 2. Алкены», научить получать этилен и проводить с ним опыты;. Оборудование: на столах учащихся: лабораторный штатив с лапкой, спиртовка, спички, пробирки в штативе, газоотводная трубка, песок, бромная вода, раствор перманганата калия, этиловый спирт, концентрированная серная кислота. Это значит, что произошла химическая реакция , и образовалось.






Работа проводится учащимися самостоятельно под контролем учителя. Предлагаю результат моей многолетней работы по подготовке и проведению практических работ в общеобразовательной школе на уроках химии в 8—9-х классах: «Получение и свойства кислорода», «Приготовление растворов солей с определенной массовой долей растворенного вещества», «Обобщение сведений о важнейших классах неорганических соединений», «Электролитическая диссоциация», «Подгруппа кислорода» см. Все они апробированы мною на занятиях. Их можно использовать при изучении школьного курса химии как по новой программе О. Габриеляна, так и по программе Г. Рудзитиса, Ф.
- Практические работы по химии. 9 класс
- ЗАДАЧИ: формирование умений наблюдать за явлениями, описывать их и делать выводы; продолжить формирование умений и навыков учащихся обращению с лабораторным оборудованием, необходимым для проведения химического эксперимента; азвитие способностей учащихся анализировать и делать выводы по результатам проведенного. Оборудование и реактивы Колбы, химические стаканы, пробирки, стеклянные палочки, фильтровальные воронки, бумажные фильтры, чашки Петри, шпатели, пипетка, лабораторный штатив; вода, нефть, древесные опилки, мел порошок.
- Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане. А ещё раздел с полезными материалами, календарь занятий и уведомления о предстоящих уроках.
- Разделы: Химия. Приборы: пробирки, газоотводная трубка, стакан химический, ложечка для сжигания, стеклянная пластина, вата, пробка, сухое горючее, спички.
- Цель : Научиться выполнять очистку загрязненной поваренной соли, используя необходимые способы разделения смесей. Что осталось на дне чашечки.
- Практические работы по химии. Тема: Экспериментальные задачи по распознаванию и получению веществ.
- Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine. На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны.
- В вашем браузере отключен JavaScript.
- Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане.
- Влияние различных факторов на скорость химической реакции.







Оформить бесплатно документ можно здесь. Оборудование и реактивы: раствор пероксида водорода, оксид марганца IV , пробирки, тлеющая лучинка. Вычислите, сколько кислорода содержится в вашем организме. Для скачивания материалов с сайта необходимо авторизоваться на сайте войти под своим логином и паролем.



































