Химические свойства
Валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама VI; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Химические свойства[править | править код]
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот:
Реагирует с расплавленными щелочами в присутствии окислителей:
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Примечания[править | править код]
- ↑ 1 2 3 4 Ракова Н. Н. ВОЛЬФРАМ. bigenc.ru. Большая российская энциклопедия – электронная версия (2016). Дата обращения 8 августа 2020.
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 5 Tungsten: physical properties (англ.). WebElements. Дата обращения 17 августа 2013.
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — P. 6-134. — 2828 p. — ISBN 1420090844.
- ↑ См. обзор измерений в: Tolias P. (2017), Analytical expressions for thermophysical properties of solid and liquid tungsten relevant for fusion applications, arΧiv:1703.06302
- ↑ 1 2 3 4 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 418. — 623 с. — 100 000 экз.
- ↑ Теплофизические свойства вольфрама
- ↑ Большая советская энциклопедия Гл. ред. А. М. Прохоров. — 3-е изд. — М. : Сов. энцикл., 1969 – 1978
- ↑ Титан – металл будущего.
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 347.
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 348.
- ↑ Brian Wheeler. Tungsten Shielding Helps at Fukushima Daiichi. Power Engineering Magazine (1 июля 2011).
- ↑ Murata Taisuke, Miwa Kenta, Matsubayashi Fumiyasu, Wagatsuma Kei, Akimoto Kenta, Fujibuchi Toshioh, Miyaji Noriaki, Takiguchi Tomohiro, Sasaki Masayuki, Koizumi Mitsuru. Optimal radiation shielding for beta and bremsstrahlung radiation emitted by 89Sr and 90Y: validation by empirical approach and Monte Carlo simulations // Annals of Nuclear Medicine. — 2014. — 10 мая (т. 28, № 7). — С. 617—622. — ISSN 0914-7187. — doi:10.1007/s12149-014-0853-6.
- ↑ Kobayashi S., Hosoda N., Takashima R. Tungsten alloys as radiation protection materials // Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. — 1997. — Май (т. 390, № 3). — С. 426—430. — ISSN 0168-9002. — doi:10.1016/S0168-9002(97)00392-6.
- ↑ Soylu H. M., Yurt Lambrecht F., Ersöz O. A. Gamma radiation shielding efficiency of a new lead-free composite material // Journal of Radioanalytical and Nuclear Chemistry. — 2015. — 17 марта (т. 305, № 2). — С. 529—534. — ISSN 0236-5731. — doi:10.1007/s10967-015-4051-3.
- ↑ по данным “Цены на вольфрам”
- ↑ Федонкин М. А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь // Палеонтологический журнал. — 2003. — № 6. — С. 33—40
- ↑ 1 2 Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — doi:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.
- ↑ F. A. Danevich et al. α activity of natural tungsten isotopes (англ.) // Phys. Rev. C : journal. — 2003. — Vol. 67. — P. 014310. — doi:10.1103/PhysRevC.67.014310.
- ↑ C. Cozzini et al. Detection of the natural α decay of tungsten (англ.) // Phys. Rev. C : journal. — 2004. — Vol. 70. — P. 064606. — doi:10.1103/PhysRevC.70.064606.
Вольфрам свойства и применение
Как говорилось, наибольшую популярность вольфрам получил в производстве обычных лампочек накаливания. Впервые ее изобрели в начале 19 века. Помимо примитивных изделий W участвует в изготовлении трубок для рентгеновского оборудования, составляющих вакуумных печек и других устройств, использующихся при высоких температурах.
Интересный факт! Сталь включает в свой состав вольфрамовые соединения. Благодаря этому она может похвастаться прочностью и надежностью. Подобные сплавы хорошо зарекомендовали себя в производстве оборудования для бурения скважин, а также в медицинской отрасли и машиностроении.
Самый износоустойчивый сплав, полученный из вольфрама, называется победит. Его нередко применяют в химической сфере, где изготавливают краски и пигменты.
История и происхождение названия[править | править код]
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» – лат. spuma lupi или нем. Wolf Rahm. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирал олово как волк овцу»).
В английском и французском языках вольфрам называется tungsten (от швед. tung sten — «тяжёлый камень»). В 1781 году знаменитый шведский химик Карл Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама)[источник не указан 2833 дня]. В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла[источник не указан 2833 дня]. При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
ГЛАВА I. ХИМИЯ В ЦЕНТРЕ ЕСТЕСТВОЗНАНИЯ
Вопросы
1. Какие учебные предметы относятся к естественно−научным?
Ответ:
Биология, география, астрономия, экология, геология, химия.
2. Приведите примеры положительного воздействия человека на окружающую среду.
Ответ:
Примерами положительного воздействия человека на окружающую среду является:1. Рациональное использование природных ресурсов.2. Разработка и установка очистительных сооружений.3. Раздельный сбор и переработка мусора.4. Внедрение безотходных технологий производства.5. Создание заповедников, заказников.6. Воспроизводство лесов.
3. Приведите примеры отрицательного воздействия человека на природу.
Ответ:
Примерами отрицательного воздействия человека на природу являются:1. Вырубка лесов.2. Загрязнение воды.3. Отравление промышленными выбросами атмосферы и почвы.4. Уничтожение растений и животных.5. Нерациональное использование природных ресурсов.
4. Что изучает химия?
Ответ:
Химия изучает вещества, их строение, свойства и превращения одних веществ в другие.
5. Из следующего перечня названий выпишите отдельно тела и вещества: снежинка, капля росы, вода, льдинка, сахар−песок, кусочек сахара, мел, школьный мелок. Сколько тел и сколько веществ названо в этом списке?
Ответ:
Тела: снежинка, капля росы, льдинка, кусочек сахара, школьный мелок.Вещества: вода, сахар−песок, мел.Тел в списке названо пять, веществ в списке три.
6. Сравните свойства веществ (т.е. установите сходство и различие между ними):а) углекислого газа и кислорода;б) азота и углекислого газа;в) сахара и соли;г) уксусной и лимонной кислоты.
Ответ:
а) Кислород и углекислый газСходства: газообразные вещества, без запаха, без цвета, тяжелее воздухаРазличия: кислород поддерживает горение, поддерживает дыхание, углекислый газ не поддерживает горение и дыхание; углекислый газ тяжелее кислорода; кислород состоит из одного химического элемента, углекислый газ из двух химических элементов.б) Азот и углекислый газСходства: газообразные вещества без цвета, без запаха; не поддерживают горение и дыхание.Различия: азот состоит из одного химического элемента, углекислый газ из двух химических элементов; азот не растворим в воде, углекислый газ растворим; углекислый газ тяжелее азота.в) Сахар и сольСходства: твердые бесцветные кристаллы, хорошо растворимы в воде, без запаха, хрупкие, имеют вкус.Различия: соль на вкус соленая, сахар − сладкий; сахар горюч, соль нет.г) Уксусная и лимонная кислотаСходства: на вкус кислые, бесцветные, хорошо растворимы в воде.Различия: уксусная кислота − жидкость с резким запахом, лимонная кислота − кристаллический порошок, без запаха.
7. Какие свойства алюминия лежат в основе его применения (см. рис.5)Рис.5 — Области применения алюминия, обусловленные его свойствами
Ответ:
Получение
При добыче вольфрама из руд образуется оксид WO3, который впоследствии восстанавливается с помощью водорода при нагреве до металлического порошкообразного вещества. Ввиду высоких температурных условий плавления получить небольшие размеры металла довольно затруднительно. А потому полученный порошок спрессовывают и спекают в атмосфере водорода. Затем через него проходит мощное напряжение, из-за чего W накаливается до 3 000 градусов. Таким образом, вольфрам поддается плавлению.
Сам же элемент достаточно редко встречается в природе. После всех веществ он занимает лишь 57-е место. Находят его, как правило, в подземных водах в виде своего иона или различных соединений.
Пройти практику можно с ГДЗ к учебнику Габриеляна
Химия нравится многим школьникам, так как на уроках учителя показывают много увлекательных и интересных опытов. Да и в целом эта наука способна по-настоящему увлечь. Конечно, трудности неизбежны, особенно при решении уравнений. Поэтому ученикам нужно запоминать все формулы, иначе они рискуют наделать много ошибок. Решебник Габриеляна по химии 9 класс, написанный в соответствии с ФГОС, позволит разобраться во всех непонятных темах и хорошо усвоить новую информацию.
Благодаря сведениям, почерпнутым из справочника, учащиеся получают возможность:
- научиться правильно решать сложные задачи;
- без ошибок выполнять самые обширные домашние задания;
- дополнительно тренироваться для отработки практики;
- выявлять свои слабые места.
Практические номера имеют важное значение для понимания теоретических законов химии. Подростки учатся находить основу химических явлений, основываясь на сделанных расчетах
Стоит допустить ошибку, как простая реакция может обернуться глобальным взрывом, способным уничтожить всю планету. С помощью решебника девятиклассники точно поймут когда и какие действия они должны совершать, чтобы добиться нужного результата.
Влияет ли решебник на оценки?
Уроки по предмету, хоть и важны, но на них в школе отводится очень мало времени. Как правило, это 1-2 часа в неделю. При этом объемы и сложность информации, которую нужно понять и запомнить весьма велики. Так что порой без помощи ребятам бывает очень трудно справиться с полученными заданиями. Поэтому использование сборника ответов по химии для 9 класса автор Габриелян (ФГОС) можно считать не просто прихотью ленивых учеников, а насущной необходимостью для каждого школьника.
Применяя пособие для систематических занятий, подростки:
- лучше разберутся в дисциплине;
- поднимут успеваемость по предмету;
- станут добиваться хороших оценок по тестированиям;
- не будут зависеть от помощи со стороны.
В издании есть все необходимое, от верных ответов до дополнительных комментариев авторов, что позволит досконально освоить учебный материал самостоятельно. Но имеются и свои нюансы при работе с решебником. Если просто списывать из него готовые решения, то пользы это не принесет. Только анализ выполненных д/з и тщательный разбор всех приведенных в сборнике сведений поможет приобрести необходимые знания.
СВОЙСТВА
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C). Плотность чистого вольфрама составляет 19,25 г/см³. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32·10−9). Твердость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с. Является парамагнетиком.
Вольфрам является одним из наиболее тяжелых, твердых и самых тугоплавких металлов. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Получение[править | править код]
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
ПРИМЕНЕНИЕ
Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках. Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка. Некоторые соединения вольфрама применяются как катализаторы и пигменты. Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К). Искусственный радионуклид 185 W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184 W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
-
Внеурочная деятельность 3 класс шахматы в школе
-
Школа 1798 педагогический состав
-
Что такое боевая колесница кратко
-
Как вы понимаете выражение распоряжаться имуществом кратко
- Почему хлеб черствеет кратко
Вольфрамовый карбид
Примерно половина добываемого вольфрама используется в производстве твердых металлических веществ. Сюда же входит карбид, температура плавления которого достигает почти 3 000 градусов. Данный металл выглядит как химическое соединение, в состав которого входит одинаковое число атомов вольфрама и углерода. Такой сплав обладает особенными показателями. Сам же W делает его настолько прочным и твердым, что по характеристикам он превосходит сталь в несколько раз.
Наиболее распространенной продукцией, которую делают из карбида, являются режущие предметы. Некоторые из них имеют высокие требования к температурной устойчивости, а потому этот сплав оптимален для изготовления. Помимо этого соединение хорошо зарекомендовало себя в производстве:
- частей воздушных судов и легковых авто;
- деталей для космических аппаратов;
- медицинских хирургических приборов;
- украшений (кольца, серьги, колье);
- шариков для ручек премиум-сегмента.
Мединструменты, включающие в себя сплав, используются в области полостной хирургии. Они превосходят в цене приборы из стали, но отличаются более высокими показателями. То же самое относится к ювелирным изделиям: отполированный металл долгие годы сохраняет блестящий и изысканный вид.
Вольфрам имеет одни из самых высоких характеристик. У него уникальные физические и химические параметры, похвастаться которыми сможет далеко не каждый металл. Несмотря на маленькую распространенность, он встречается в быту и производстве. Для укрепления других компонентов из него нередко делают сплавы.
Надеемся, статья была интересной и познавательной. Читайте предыдущие статьи и ждите новых полезных публикаций на нашем сайте!
Как используется
Свойства вольфрама обозначили главного потребителя. Это металлургия. Она создает конечный продукт и исходники для других отраслей промышленности.
Порошковый вольфрам – основа либо компонент твердых, жаропрочных износоустойчивых сплавов, премиальных марок сталей.
Металл, сплавы
Из тугоплавкого металла и сплавов создают широкий ассортимент продукции:
- Узлы и детали авиационных, ракетных двигателей.
- Элементы электровакуумных приборов (кинескопы, нити накаливания).
Нить накаливания из вольфрама
Характеристики металла подошли оборонному комплексу: танковая, торпедная броня, крупнокалиберные снаряды, пули. А также суперскоростные роторы гироскопов, контролирующих траекторию полета баллистических ракет.
Вольфрам в слитках
Соединения
Обширен спектр применения вольфрамовых соединений:
- Без дителлурида невозможно преобразование тепла в электричество.
- Карбид – основа сплавов и композитов для механической обработки металлов и неметаллов. У горнодобытчиков, нефтяников, газовиков – для бурения скважин.
- Сульфид – термостойкая (до 500°C) смазка.
- Трехокись – материал для создания электролита топливных элементов, работающих при повышенных температурах.
Соединения вольфрама закупают производители лаков, красок, текстиля.
Другие формы
Изотоп W184 – компонент сплавов с изотопами урана. Из них делают ракетные двигатели на ядерном топливе.
Радионуклид искусственного происхождения (W185) востребован как детектор излучений (включая рентгеновское) ядерным сегментом физики и медицины.
Преимущества ГДЗ
В отличие от основного учебника, в онлайн-справочнике подробно описывается каждая тема, а также приведено больше ярких примеров. Но эти две книги дополняют друг друга. Без них невозможно хорошенько подготовиться к какому-либо испытанию. «ГДЗ по химии за 9 класс Габриелян О. С. (Дрофа)» обладает целым рядом плюсов. Во-первых, сборник решенных заданий и правильных ответов находится в электронном доступе. Во-вторых, благодаря ему можно научиться применять полученные знания в деле. А этот ценный навык пригодится не только при выполнении домашних заданий, но и при изучении остальных школьных дисциплин. В-третьих, справочником могут воспользоваться ребята с любым уровнем подготовки.
§ 42. По теме: Характерные химические свойства неорганических веществ. Вопросы к §
§ 2. По теме: Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды. Лабораторный опыт§ 3. По теме: Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Лабораторный опыт
§ 6. По теме: Катализаторы и катализ. Лабораторный опыт
№9 №10 №11§ 11. По теме: Химические свойства металлов. Лабораторный опыт§ 12. По теме: Получение металлов. Лабораторный опыт§ 14. По теме: Щелочные металлы. Лабораторный опыт§ 15. По теме: Бериллий, магний и щелочноземельные металлы. Лабораторный опыт§ 16. По теме: Алюминий. Лабораторный опыт
§ 21. По теме: Вода в жизни человека. Лабораторный опыт
№24 №25§ 23. По теме: Соединения галогенов. Лабораторный опыт§ 25. По теме: Кислород. Лабораторный опыт§ 26. По теме: Сера. Лабораторный опыт§ 27. По теме: Соединения серы. Лабораторный опыт§ 29. По теме: Аммиак. Лабораторный опыт§ 30. По теме: Соли аммония. Лабораторный опыт
ГЛАВА II. МАТЕМАТИКА В ХИМИИ
Вопросы
1. Что такое относительная атомная масса? Почему эта величина не имеет размерности?
Ответ:
Относительная атомная масса — величина, показывающая, во сколько раз масса атома данного элемента больше массы атома водорода, принятой за единицу.Относительная атомная масса — безразмерная величина, так как представляет собой отношение массы атома элемента к массе атома водорода.
2. Что такое относительная молекулярная масса? Как она рассчитывается?
Ответ:
Относительная молекулярная масса − это отношение массы молекулы или формульной единицы к атомной единице массы.Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.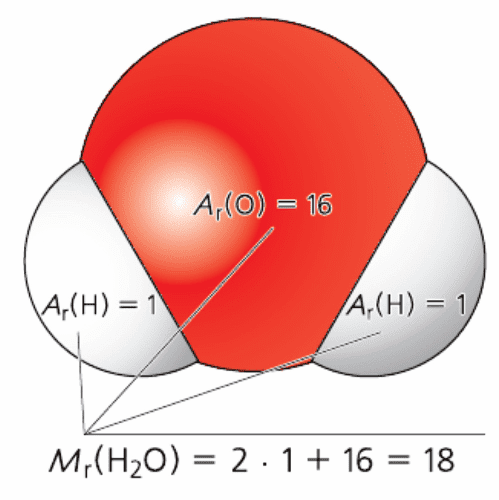 Рис. 68. Расчёт относительной молекулярной массы воды
Рис. 68. Расчёт относительной молекулярной массы воды
3. В состав молекулы фосфорной кислоты входят три атома водорода, один атом фосфора и четыре атома кислорода. Найдите относительную молекулярную массу этого вещества
Ответ:
$M_{r}$($H_{3}PO_{4}$) = 3 * 1+ 31+ 4 * 16 = 98
4. Рассчитайте относительные молекулярные массы веществ по их формулам: $Br_{2}$, $H_{2}O$, $CO_{2}$, $H_{2}SO_{4}$, $KOH$, $BaCl_{2}$. Значения относительных атомных масс найдите по таблице Д. И. Менделеева, округлите их до целых чисел (за исключением хлора, $A_{r}$(Cl) = 35,5).
Ответ:
1) $M_{r}$ ($Br_{2}$) = 2 * 80 = 1602) $M_{r}$ ($H_{2}O$) =2 * 1+16 = 183) $M_{r}$ ($CO_{2}$) = 12+2 * 16 = 444) $M_{r}$ ($H_{2}SO_{4}$) = 2 * 1+32+4 * 16 = 985) $M_{r}$ ($KOH$) = 39+16+1 = 566) $M_{r}$ ($BaCl_{2}$) = 137+ 2 * 35,5 = 208
5. Атом серы образует с атомами кислорода два сложных вещества (их называют оксидами) разного состава. Относительная молекулярная масса первого оксида равна 64, а второго — 80. Выведите формулы этих оксидов.
Ответ:
1) $M_{r}$ ($SO_{x}$) = 6432+16x = 6416x = 32x = 2Ответ: $SO_{2}$2) $M_{r}$ ($SO_{x}$) = 8032+16x =8016x = 48x = 3Ответ: $SO_{3}$
6. Не производя расчётов, а только на основании значений относительных атомных масс (найдите их по таблице Д. И. Менделеева) определите, у какого из веществ, формулы которых приведены ниже, наибольшая и наименьшая относительные молекулярные массы:а) селеноводород $H_{2}Se$;б) вода $H_{2}O$;в) теллуроводород $H_{2}Te$;г) сероводород $H_{2}S$.
Ответ:
ПРОИСХОЖДЕНИЕ
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания. Также есть месторождения вольфрама в Армении и других странах.
ЗАПАСЫ И ДОБЫЧА
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре около 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Золото или вольфрам? Вот как узнать…
Надеемся, что Бундесбанк и конечно, немецкий народ, используют что-нибудь из этого в ближайшем будущем (до 2021 года включительно).
Ультразвуковой контроль золотых слитков
Применение: неразрушающая проверка физической целостности золотых слитков.
Пояснения:
Золотые слитки мошеннически подделывались путём вставки брусков не драгоценного металла, обладающего похожей плотностью. Такие вставки сложно или невозможно обнаружить путём взвешивания, рентгенографии или рентгеновской люминесценции, поэтому некоторые технологи по металлу прибегают к сверлению отверстий или разрезанию слитков с целью проверки целостности. Однако с помощью простого ультразвукового теста можно быстро и надёжно определить местоположение вставок без необходимости сверлить, резать или иным образом изменять слиток.
Оборудование:
Любой дефектоскоп Olympus или прибор с фазированной антенной решёткой (ФАР), например: EPOCH XT, EPOCH 600, EPOCH 1000, OmniScan SX и OmniScan MX2. Рекомендуется использовать частоту преобразователя 2,25 МГц.
Принцип:
В поддельном слитке золота с внутренней вставкой другого металла предсказуемым образом изменяется путь, по которому ультразвуковые волны проходят через металл. Вставки материала, отличного от золота, как и пустоты внутри слитка, изменят углы отражения волн. Большие вставки, занимающие большую часть слитка, могут быть также обнаружены по изменению скорости распространения звука.
1. Метод отражения импульса/эха
Ультразвуковые волны, проходящие через любую среду, будут распространяться в одном направлении, пока не достигнут границы с другим материалом, что вызовет их отражение в направлении источника.
Ультразвуковые дефектоскопы и приборы с ФАР генерируют импульсы высокочастотных звуковых волн, источниками которых служат небольшие ручные преобразователи. Звуковая энергия взаимодействует с тестируемым объектом, прибор измеряет и отображает картину распределения отражённых сигналов. Сигналы, отражённые изнутри золотого слитка, а не с его противоположной поверхности, изменяют картину и указывают на наличие либо вставки другого металла, либо внутренней полости.
При проведении этого испытания сначала регистрируют эталонный сигнал датчика, т. е. сигнал, отражённый нижней поверхностью известного слитка золота. Для измерения времени распространения ультразвуковой волны до нижней поверхности можно использовать стробимпульсы. Все отражённые сигналы из зоны, отмеченной стробимпульсом, указывают на то, что звуковой поток отражён от границы неоднородности материала, и необходимо провести дальнейшую проверку слитка. Ниже показаны типичные картинки на экране.
Изображения на экране дефектоскопа в случаях монолитного металла (выше) и металла с нарушением (ниже).
Примечание. Сигнал появляется в интервале, отмеченном красным.
Изображения монолитного металла (выше) и металла с неоднородностью (ниже), полученные с помощью прибора ФАР. Неоднородность отображается цветом там, где должен быть белый фон.
2. Метод измерения скорости
Скорость звука в чистом золоте равна 3,240 м/с или 0,1275 дюйм/мкс. В более твёрдых сплавах золота, используемых в ювелирных изделиях, скорость выше, но каждый сплав также характеризуется определённым значением скорости. Если скорость распространения звука отлична от ожидаемой величины, это означает, что состав металла был изменён.
Для проведения этого теста датчик располагают над известным слитком золота и регистрируют сигнал, отражённый задней поверхностью. Отражённый сигнал может быть помечен стробимпульсом. Если в слитке определённой толщины положение отражённого сигнала изменяется, значит, изменилась скорость звука в металле, и слиток подлежит дальнейшей проверке другими методами. Наиболее распространённые примеси повышают скорость звука, и отражённый сигнал смещается влево.
Примечание. Этот же метод с небольшими изменениями может применяться для других драгоценных металлов — серебра и платины.
Конечно, судя по фотографиям, на которых сотрудник Бундесбанка использует один из приборов Olympus для проверки подлинности золота, можно с уверенностью сказать, что герр Вайдман (Weidmann) хорошо осведомлён о том, что не всё то, что блестит в картеле глобального центробанка, является золотом.
Биологическая роль[править | править код]
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни.
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.






























