Задания
§1. Окислительно-восстановительные реакции
1
2
3
4
5
6
Тестовые задания
§2. Тепловые эффекты химических реакций
2
3
4
§3. Скорость химических реакций
1
2
3
4
Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии
2
3
Тестовые задания
§6. Сущность процесса электролитической диссоциации
1
2
3
4
§7. Диссоциация кислот, оснований и солей
1
2
3
Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации
1
2
3
4
Тестовые задания
§9. Реакции ионного обмена
1
2
3
4
5
6
Тестовые задания
Лабораторный опыт
§10. Гидролиз солей
1
2
3
Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Практическая работа 2
§12. Характеристика галогенов
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§13. Хлор
1
2
3
4
5
6
7
Тестовые задания
§14. Хлороводород: получение и свойства
1
2
3
§15. Соляная кислота и её соли
1
2
3
4
Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств
Практическая работа 3
§17. Характеристика кислорода и серы
1
2
3
4
Тестовые задания
Лабораторный опыт
§18. Свойства и применение серы
1
2
3
Тестовые задания
§19. Сероводород. Сульфиды
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота
1
2
4
Тестовые задания
Лабораторный опыт
§21. Оксид серы(VI). Серная кислота
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота
1
2
3
§24. Аммиак
1
2
3
Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств
Практическая работа 5
§26. Соли аммония
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§27. Азотная кислота
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты
1
2
3
§29. Фосфор
1
2
3
4
Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли
1
2
3
4
§31. Характеристика углерода и кремния. Аллотропия углерода
1
2
3
§32. Химические свойства углерода. Адсорбция
1
2
3
4
5
6
7
Тестовые задания
§33. Оксид углерода(II) — угарный газ
1
2
3
Тестовые задания
§34. Оксид углерода(IV) — углекислый газ
1
2
3
4
Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе
1
2
3
4
5
6
7
Тестовые задания
Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Практическая работа 6
§37. Кремний. Оксид кремния(IV)
1
2
3
Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент
1
2
3
4
§39. Характеристика металлов
1
2
3
4
5
6
Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения
1
2
3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов
1
2
3
Лабораторный опыт
§42. Сплавы
1
2
3
§43. Щелочные металлы
1
2
3
4
5
6
Тестовые задания
§44. Магний. Щелочноземельные металлы
1
2
3
4
5
Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий
1
2
3
4
5
6
7
8
Тестовые задания
§47. Важнейшие соединения алюминия
1
2
3
4
5
Лабораторный опыт
§48. Железо
1
2
3
4
Тестовые задания
§49. Соединения железа
1
2
3
4
Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»
Практическая работа 7
§51. Органическая химия
1
2
3
4
5
6
Тестовые задания
§52. Предельные (насыщенные) углеводороды
1
2
3
4
Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды
1
2
3
4
5
§54. Полимеры
1
2
§55. Производные углеводородов. Спирты
1
2
3
Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры
1
2
3
4
5
6
Тестовые задания
§57. Углеводы
1
2
3
§58. Аминокислоты. Белки
1
2
3
4
5
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый С. Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов
, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией
.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяков- ский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы
. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из молекул воды.
Молекулы воды представляют собой диполи
(два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
Как правило, легче всего диссоциируют вещества с ионной связью
и, соответственно, с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения
. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
1) ориентация молекул (диполей) воды около ионов кристалла;
2) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с помощью следующего уравнения:
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная связь (например, молекулы хлороводорода HCl, смотри ниже); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную; последовательность процессов, происходящих при этом, будет такой:
1) ориентация молекул воды вокруг полюсов молекул электролита;
2) гидратация (взаимодействие) молекул воды с молекулами электролита;
3) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
4) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно процесс диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Ассоциация в растворах происходит параллельно с диссоциацией, поэтому в уравнениях реакций ставят знак обратимости.
Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди Cu 2+ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Cu 2+ nH 2 O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Использование солей для получения ги
Чтобы получить ги, можно использовать различные соли, такие как соль натрия (NaCl), сульфат меди (CuSO4), хлорид меди (CuCl2) или существующие на вашем столе субстанции, содержащие эти соли, например столовую соль, соль медицинским использованием или даже соль для посудомоечных машин.
Процесс получения ги с использованием солей требует следующих шагов:
- Подготовьте раствор соли, растворив ее в воде. Количество соли зависит от желаемой концентрации раствора и нужного количества ги.
- Погрузите материал, который вы хотите обработать, в раствор соли. Материал может быть древесным изделием, бумагой или тканью.
- Разместите погруженный материал в закрытом контейнере, чтобы избежать испарения раствора.
- Оставьте материал в контейнере на протяжении нескольких дней или недель, в зависимости от желаемой степени пористости и цветности ги.
- После нужного времени извлеките материал из раствора и дайте ему высохнуть.
Использование солей для получения ги позволяет создавать эффектные и уникальные изделия, которые могут быть использованы в качестве украшений, поделок или элементов декора
Однако, перед использованием солей, рекомендуется ознакомиться с инструкциями и надлежащими мерами предосторожности, чтобы избежать возможных проблем со здоровьем или повреждений материалов
Попробуйте использовать соли для получения ги и откройте для себя новые возможности творчества и декорирования!
Биологическое применение растворов для получения ги
Растворы химических веществ, находящихся на столе, могут быть полезными для получения ги в биологических исследованиях. Они могут использоваться для замораживания и хранения образцов биологических материалов, а также для проведения экспериментов и анализа данных.
Замораживание и хранение образцов
Растворы химических веществ могут быть использованы для замораживания и хранения образцов биологических материалов, таких как пробирки с кровью или тканями. Например, растворы сухого льда или замороженной этилового спирта могут использоваться для создания низких температур, необходимых для сохранения образцов в замороженном состоянии.
Эксперименты и анализ данных
Растворы химических веществ также могут быть применены для проведения экспериментов и анализа данных в биологических исследованиях. Например, растворы буферов могут использоваться для поддержания постоянного pH в реакционной среде
Это особенно важно при проведении экспериментов, связанных с изучением ферментативных реакций или взаимодействий между молекулами
Также растворы химических веществ используются для проведения химического анализа образцов биологического происхождения. Например, растворы реагентов могут использоваться для определения наличия или концентрации определенных биомолекул, таких как белки, углеводы или нуклеиновые кислоты. Это помогает ученым получать данные о составе и структуре биологических образцов с целью их дальнейшего изучения и интерпретации.
Применение кислот в процессе получения ги
Разложение органических веществ
Для начала процесса получения ги необходимо разложить органические вещества, такие как древесина или уголь, на составляющие элементы. В данном случае применяются кислоты, такие как серная или фосфорная. Они обладают достаточной коррозионной активностью, чтобы разложить органические связи и освободить углеродные и другие элементы, необходимые для получения ги.
Извлечение золы
После разложения органических веществ необходимо извлечь золу, оставшуюся после их сгорания. Для этого используется кислотный раствор, который обеспечивает растворение минеральных остатков и отделение их от полученной ги. Для этой цели можно применять кислоты различной концентрации в зависимости от состава и свойств золы.
Далее, после извлечения золы, последнюю необходимо удалять из полученной ги и смешивать с другими добавками. Именно этот процесс придает ги требуемые качества и свойства.
Как видно, кислоты являются незаменимым инструментом в процессе получения ги, обеспечивая его основные этапы: разложение органических веществ и извлечение золы. Использование правильных кислот и их концентраций является важным фактором для достижения желаемого результата.
Последние заданные вопросы в категории Химия
Химия 09.01.2024 01:03 391 Юдаева Ульяна
Запишите диссоциацию веществ: NaOH, BaSO4, H3PO4, CuSO4, Fe(OH)3, ZnCl2, Ba(OH)2, Na2SO3, ZnSiO3,
Ответов: 1
Химия 08.01.2024 20:37 281 Сергеев Никита
Краткому ионному уравнению 2H++S2-=H2S соответсвует взаимодействие между
Ответов: 1
Химия 08.01.2024 20:25 405 Пряничников Александр
Насыпал на блюдце немного соды и добавил по каплям столовый уксус Вывод : -? Наблюдение : -?
Ответов: 1
Химия 08.01.2024 18:47 275 Бренюк Паша
1 В предложенном перечне укажите название электролита, при диссоциации которого в качестве катионов
Ответов: 1
Химия 08.01.2024 15:31 182 Белоусова Амалия
Расставить степени окисления у атомов для следующих веществ: 1.MnCI4 2.Cu20. 3.Na2S 4.NaOH
Ответов: 1
Химия 08.01.2024 14:21 209 Дорошина Елена
Выберите пары, вещества в которых могут реагировать с образованием хлороводорода. H2 и Cl2 H2S и
Ответов: 1
Химия 08.01.2024 11:36 188 Шалимова Машуля
нужно рассчитать массу 2 моль газа водорода и число молекул в этом количестве вещества. с \»дано\»
Ответов: 1
Химия 08.01.2024 11:20 213 Кошля Аліна
Оксиду кальция массой 28 г соответствует количество вещества: 1) 1 моль 2) 0, 1 моль 32 моль 4105
Ответов: 1
Химия 08.01.2024 09:36 180 Булихова Анастасия
1. Какова масса 3,01×1023 атомов железа? 2. Какова масса 0,2 моль серной кислоты H2SO4? 3. Какое
Ответов: 1
Химия 08.01.2024 09:43 122 Кирьянова Юлия
Определите валентность элемента, стоящего на первом месте в формуле газа, который выделяется в
Ответов: 1
Каким образом помогут ГДЗ по химии для 9 класса (авторы: Г. Е. Рудзитис, Ф. Г. Фельдман)
Отличники и многие хорошисты обычно имеют явное преимущество перед своими сверстниками:
- Они иногда могут пропускать занятия. Происходит это из-за того, что они – любимчики учителей. Их целеустремленность, пунктуальность и умение сосредотачиваться подкупают и служат гарантом, что ни одна тема не будет упущена, а все заданные упражнения будут выполнены;
- Бонусы при поступлении приносит посещение конкурсов и олимпиад. Помимо этого, такая активность позволяет меньше волноваться на контрольных работах, тестах, ЕГЭ и ОГЭ;
- Они почти никогда не подвергаются травле со стороны одноклассников.
Чтобы добиться такого положения, необходимо стараться. Так, требуется не прогуливать учебу без повода, заниматься дополнительно и выявлять все пробелы и упущенные моменты. Особенно это касается науки о веществах. Она нужна для значительного спектра специальностей, но все же большинство не выбирают эту дисциплину в качестве государственного экзамена, однако получить заветную медаль мечтает каждый.
Основные этапы программы по химии
Девятиклассников впереди ожидают большие нагрузки, ведь помимо основных уроков они должны готовиться и к экзаменам. Кроме того, ребятам предстоит определиться, продолжат ли они свое обучение в школе или пойдут получать какую-то определенную профессию. Некоторые специальности требуют хороших знаний по химии, да и вообще в жизни не раз могут пригодиться полученные навыки, поэтому детям стоит более внимательно относиться к освоению столь непростого предмета. Отличным подспорьем для учеников с любым уровнем знаний станет сборник ГДЗ к учебнику по химии 9 класс Шиманович, Василевская, Красицкий (Народная асвета, 2019 г.).
На девятом году обучения проходят следующий материал:
- Окислительно-восстановительные реакции.
- Электролитическая диссоциация кислот, оснований и солей.
- Уравнения химических реакций в молекулярной и ионной формах.
- Электронное строение атома хлора.
- Аллотропные модификации кислорода.
- Применение металлов и сплавов, и т.д.
Сложнее всего подросткам даются формулы и уравнения. Пока учитель объясняет материал у доски и демонстрирует опыты, все кажется относительно понятным. А вот дома при выполнении практических упражнений начинаются проблемы. Иногда учащиеся совсем не понимают, что от них требуется. Это приводит к появлению ненужных ошибок и поверхностным знаниям, которые не помогут справиться с более-менее трудными заданиями. Решебник дает возможность всесторонне закрепить тематику и углубить навыки.
Химия 9 класс (Габриелян) Проверочная работа № 34
ПР-34. Вариант 1
№ 1. При испытании веществ на электропроводность лампочка прибора загорится, если погрузить электроды в 1) кристаллическую поваренную соль 2) кристаллический сахар 3) раствор сахара в воде 4) раствор поваренной соли в воде 5) расплав поваренной соли ОТВЕТ: 4, 5.
№ 2. К сильным электролитам относят 1) все щёлочи 2) все растворимые кислоты 3) все оксиды 4) все растворимые вещества 5) все растворимые соли ОТВЕТ: 1, 5.
№ 3. Слабые электролиты — это 1) гидроксид меди (II) 2) плавиковая кислота 3) гидроксид натрия 4) хлорид аммония, 5) сернистый газ ОТВЕТ: 1, 2.
№ 4. Сильные кислоты — это 1) плавиковая, 2) азотная, 3) соляная, 4) сероводородная, 5) сернистая. ОТВЕТ: 2, 3.
№ 5. Каких частиц больше других в растворе гидрокарбоната калия? 1) КНСO3, 2) K+, 3) Н+, 4) СО32–, 5) HCO32–. ОТВЕТ: 2, 5.
№ 6. Наибольшее число ионов образуется в результате растворения в воде равных количеств 1) сернистой кислоты, 2) сульфита натрия, 3) гидросульфита натрия, 4) угольной кислоты, 5) карбоната натрия. ОТВЕТ: 2, 5.
№ 7. Для осуществления реакции Fe2+ + 2OН– = Fe(OH)2 необходимы следующие вещества 1) карбонат железа (II) 2) гидроксид железа (II) 3) сульфат железа (II) 4) гидроксид натрия 5) гидроксид магния ОТВЕТ: 3, 4.
№ 8. Сокращённому ионному уравнению H+ + OH– = H2O соответствует взаимодействие между 1) Mg(OH)2 и H2S 2) Mg(OH)2 и H2SO4 3) Ba(OH)2 и H2SO4 4) Ba(OH)2 и НСl 5) HNO3 и Ba(OH)2 ОТВЕТ: 4, 5.
№ 9. Установите соответствие взаимодействующими ионами и реагентами.Взаимодействующие ионы:A) SO42– + Ва2+ Б) 2OH– + Fe2+ B) 2H+ + SO32–Реагенты: 1) гидроксид бария и серная кислота 2) гидроксид бария и нитрат железа (II) 3) сульфит натрия и серная кислота 4) нитрат бария и серная кислота 5) нитрат железа (II) и гидроксид магния ОТВЕТ: А–4, Б–2, В–3.
№ 10. Приведите пример реакции, в результате которой образуется осадок голубого цвета, составив уравнения в молекулярной, ионной и сокращённой ионной формах. ОТВЕТCuSO4 + 2NaOH = Cu(OH)2 + Na2SO4; Cu2+ + SO42– + 2Na+ + 2OH– = Cu(OH)2↓ + 2Na+ + SO42–; Cu2+ + 2OH– = Cu(OH)2↓
Дополнительные задания
№ 1. Установите соответствие между формулой газообразного вещества и средой его водного раствора. Формула вещества: A) NH3, Б) СО2, B) SO2, Г) СО. Среда раствора: 1) кислая, 2) нейтральная, 3) щелочная. ОТВЕТ: А–3, Б–1, В–1, Г–2.
№ 2. Установите соответствие между формулой соли и типом гидролиза. Формула соли: A) АlСl3, Б) (NH4)2SO3, B) (CH3COO)2Zn, Г) Na2CO3. Тин гидролиза: 1) по катиону, 2) по аниону, 3) по катиону и аниону. ОТВЕТ: А–1, Б–3, В–3, Г–2.
№ 3. Установите соответствие между формулой соли и средой её водного раствора. Формула соли: A) K2SiO3, Б) СаСl2, B) Fe(NO3)2, Г) KNO3. Среда: 1) кислая, 2) нейтральная, 3) щелочная. ОТВЕТ: А–3, Б–2, В–1, Г–2.
Вы смотрели: Химия 9 Габриелян Проверочная 34 «Диссоциация электролитов в водных растворах. Ионные уравнения реакций» с ответами по учебнику химии для 9 класса. Цитаты из учебного пособия использованы в учебных целях.
Достоинства решебника по химии за 9 класс учебник Рудзитис
Портал станет надежным помощником и незаменимым союзником для каждого ученика, желающего добиться высоких результатов по такой непростой, но интересной дисциплине. Решебник поможет подростку нейтрализовать имеющиеся трудности в учебном процессе и сократить отставание от школьной программы. Он гарантирует правильность выполнения домашнего задания, ведь содержит в себе исключительно верные ответы и подробные пояснения авторов к решению каждого упражнения из дидактического материала. Благодаря этому ученик сможет не только подтянуть имеющиеся оценки и улучшить свою успеваемость, но и обрести множество новых знаний. Рассмотрим другие плюсы учебно-методического комплекса ГДЗ:
- Размещено в онлайн-формате и доступно к использованию круглосуточно.
- Даст возможность обрести уверенность в себе и перестать бояться получить двойку за некачественную подготовку к уроку.
- Простой и понятный интерфейс поиска верных ответов по номеру упражнения из учебника.
- Позволит закрепить пройденный в школе материал.
К тому же, если школьник научится правильно использовать вспомогательный ресурс в учёбе, то сможет существенно сократить среднее время подготовки к урокам. Электронным сборником могут воспользоваться как школьники, серьезно отстающие от программы, так и отличники. Если в первом случае справочное пособие поможет повысить академическую успеваемость, то во втором — ребята смогут совершать самопроверку регулярно и устранять самостоятельно систематические ошибки. Задача родителей — оказать своевременную моральную поддержку. Цель решебника — помочь ему в трудную минуту.
Задания
§1. Окислительно-восстановительные реакции
1
2
3
4
5
6
Тестовые задания
§2. Тепловые эффекты химических реакций
2
3
4
§3. Скорость химических реакций
1
2
3
4
Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии
2
3
Тестовые задания
§6. Сущность процесса электролитической диссоциации
1
2
3
4
§7. Диссоциация кислот, оснований и солей
1
2
3
Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации
1
2
3
4
Тестовые задания
§9. Реакции ионного обмена
1
2
3
4
5
6
Тестовые задания
Лабораторный опыт
§10. Гидролиз солей
1
2
3
Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Практическая работа 2
§12. Характеристика галогенов
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§13. Хлор
1
2
3
4
5
6
7
Тестовые задания
§14. Хлороводород: получение и свойства
1
2
3
§15. Соляная кислота и её соли
1
2
3
4
Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств
Практическая работа 3
§17. Характеристика кислорода и серы
1
2
3
4
Тестовые задания
Лабораторный опыт
§18. Свойства и применение серы
1
2
3
Тестовые задания
§19. Сероводород. Сульфиды
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота
1
2
4
Тестовые задания
Лабораторный опыт
§21. Оксид серы(VI). Серная кислота
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота
1
2
3
§24. Аммиак
1
2
3
Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств
Практическая работа 5
§26. Соли аммония
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§27. Азотная кислота
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты
1
2
3
§29. Фосфор
1
2
3
4
Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли
1
2
3
4
§31. Характеристика углерода и кремния. Аллотропия углерода
1
2
3
§32. Химические свойства углерода. Адсорбция
1
2
3
4
5
6
7
Тестовые задания
§33. Оксид углерода(II) — угарный газ
1
2
3
Тестовые задания
§34. Оксид углерода(IV) — углекислый газ
1
2
3
4
Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе
1
2
3
4
5
6
7
Тестовые задания
Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Практическая работа 6
§37. Кремний. Оксид кремния(IV)
1
2
3
Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент
1
2
3
4
§39. Характеристика металлов
1
2
3
4
5
6
Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения
1
2
3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов
1
2
3
Лабораторный опыт
§42. Сплавы
1
2
3
§43. Щелочные металлы
1
2
3
4
5
6
Тестовые задания
§44. Магний. Щелочноземельные металлы
1
2
3
4
5
Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий
1
2
3
4
5
6
7
8
Тестовые задания
§47. Важнейшие соединения алюминия
1
2
3
4
5
Лабораторный опыт
§48. Железо
1
2
3
4
Тестовые задания
§49. Соединения железа
1
2
3
4
Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»
Практическая работа 7
§51. Органическая химия
1
2
3
4
5
6
Тестовые задания
§52. Предельные (насыщенные) углеводороды
1
2
3
4
Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды
1
2
3
4
5
§54. Полимеры
1
2
§55. Производные углеводородов. Спирты
1
2
3
Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры
1
2
3
4
5
6
Тестовые задания
§57. Углеводы
1
2
3
§58. Аминокислоты. Белки
1
2
3
4
5
Специфические химические реакции для получения ги
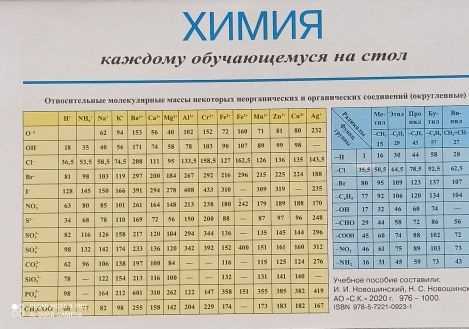
- Реакция между алюминием и йодом: Положите алюминий в контейнер и добавьте йод. Алюминий реагирует с йодом, образуя комплексное соединение из алюминия и йода. Это соединение может быть использовано для получения ги.
- Реакция между медным купоросом и натрий гидроксидом: Смешайте натрий гидроксид с медным купоросом и нагрейте смесь. В результате реакции образуется гидроксид меди, который может быть использован для получения ги.
- Реакция между серной кислотой и ферментным раствором: Смешайте серную кислоту с ферментным раствором и подождите, пока произойдет химическая реакция. В результате образуется соединение, которое можно использовать для получения ги.
Это лишь некоторые примеры химических реакций, которые можно использовать для получения ги
Важно помнить, что при работе с химическими веществами необходимо соблюдать осторожность и использовать соответствующие защитные меры
Ответы на вопрос
Отвечает Морская Виктория.
Давайте разберем процесс диссоциации для каждого из указанных веществ. Диссоциация — это процесс, при котором сложные молекулы распадаются на более простые частицы, обычно ионы, когда вещество растворяется в воде.
-
NaOH (гидроксид натрия):
NaOH→Na++OH−\text{NaOH} \rightarrow \text{Na}^+ + \text{OH}^-NaOH→Na++OH−
Гидроксид натрия полностью диссоциирует на ионы натрия и гидроксид-ионы. -
BaSO4 (сульфат бария):
BaSO4\text{BaSO}_4BaSO4
Сульфат бария практически нерастворим в воде и не диссоциирует в значительной степени. -
H3PO4 (ортофосфорная кислота):
H3PO4→H++H2PO4−\text{H}_3\text{PO}_4 \rightarrow \text{H}^+ + \text{H}_2\text{PO}_4^-H3PO4→H++H2PO4−
Ортофосфорная кислота — многопротонная кислота, и эта реакция представляет только первую стадию её диссоциации. -
CuSO4 (сульфат меди(II)):
CuSO4→Cu2++SO42−\text{CuSO}_4 \rightarrow \text{Cu}^{2+} + \text{SO}_4^{2-}CuSO4→Cu2++SO42−
Сульфат меди(II) диссоциирует на ионы меди(II) и сульфат-ионы. -
Fe(OH)3 (гидроксид железа(III)):
Fe(OH)3\text{Fe(OH)}_3Fe(OH)3
Гидроксид железа(III) плохо растворим в воде и поэтому диссоциирует лишь незначительно. -
ZnCl2 (хлорид цинка):
ZnCl2→Zn2++2Cl−\text{ZnCl}_2 \rightarrow \text{Zn}^{2+} + 2\text{Cl}^-ZnCl2→Zn2++2Cl−
Хлорид цинка диссоциирует на ионы цинка и хлорид-ионы. -
Ba(OH)2 (гидроксид бария):
Ba(OH)2→Ba2++2OH−\text{Ba(OH)}_2 \rightarrow \text{Ba}^{2+} + 2\text{OH}^-Ba(OH)2→Ba2++2OH−
Гидроксид бария полностью диссоциирует на ионы бария и гидроксид-ионы. -
Na2SO3 (сульфит натрия):
Na2SO3→2Na++SO32−\text{Na}_2\text{SO}_3 \rightarrow 2\text{Na}^+ + \text{SO}_3^{2-}Na2SO3→2Na++SO32−
Сульфит натрия диссоциирует на ионы натрия и сульфит-ионы. -
ZnSiO3 (силикат цинка):
ZnSiO3\text{ZnSiO}_3ZnSiO3
Силикат цинка плохо растворим в воде и практически не диссоциирует. -
HI (йодоводородная кислота):
HI→H++I−\text{HI} \rightarrow \text{H}^+ + \text{I}^-HI→H++I−
Йодоводородная кислота полностью диссоциирует на ионы водорода и иодид-ионы.
Эти уравнения представляют основную форму диссоциации каждого вещества в водном растворе
Обратите внимание, что степень диссоциации может зависеть от концентрации, температуры и других факторов
Основные виды растворов химических веществ
1. Насыщенные растворы – это растворы, в которых количество растворенного вещества достигает максимального значения при заданной температуре. При добавлении дополнительного вещества оно не растворяется и оседает на дне сосуда. Этот тип растворов используется при определении растворимости веществ и в химическом анализе.
2. Непрерывно-периодические растворы – это растворы, которые подвержены термическим или химическим изменениям со временем. Такие растворы используются в различных химических процессах, например, при производстве лекарств, пищевых продуктов, синтезе полимеров и других веществ.
3. Растворы с повышенной концентрацией – это растворы, в которых количество растворенного вещества превышает его растворимость при данной температуре. Эти растворы используются в различных отраслях промышленности для получения концентрированных растворов и выделения веществ из них.
4. Разбавленные растворы – это растворы, в которых количество растворенного вещества ниже его растворимости при данной температуре. Они используются в лабораторных исследованиях, приготовлении рабочих растворов и измерении концентрации веществ в растворах.
5. Изотонические растворы – это растворы, концентрация растворенных веществ в которых соответствует концентрации веществ в клетках организмов. Такие растворы применяются в медицине и биологии для инъекций, промывания ран и сохранения живых тканей.
6. Изотопические растворы – это растворы, в которых растворенные вещества содержат атомы радиоактивных изотопов. Изотопические растворы используются в ядерной медицине и в научных исследованиях для изучения метаболических процессов в организме и исследования структуры вещества.
7. Электролитические растворы – это растворы, в которых растворенное вещество (электролит) разлагается на ионы при электрическом токе. Электролитические растворы используются в электролизе, гальванических ячейках, батареях и других устройствах, а также в аналитической химии для определения концентрации ионов в растворах.
Использование оснований для получения ги
В повседневной жизни основания можно найти на кухне или в хозяйственных химикатах. Некоторые основания, такие как гидроксид натрия (NaOH) или гидроксид калия (KOH), можно найти в виде сухого порошка или в виде растворов.
Использование оснований в процессе получения ги:
- Для получения ги можно использовать раствор основания в воде. Для этого необходимо приготовить насыщенный раствор основания, добавив его в воду, при этом следует соблюдать меры безопасности и носить защитные перчатки и очки.
- Полученный раствор основания следует охладить до комнатной температуры.
- Затем в полученный раствор постепенно добавляют глицерин и аккуратно перемешивают. Это приведет к образованию плотной и гибкой массы ги.
- Полученную массу ги можно использовать для различных целей, таких как создание моделей, игрушек или использование в художественных проектах.
Использование оснований для получения ги предоставляет широкие возможности для творчества и экспериментов
Однако следует помнить, что основания являются химическими веществами и требуют осторожного обращения. Работа с ними должна проводиться с использованием защитной экипировки и соблюдением всех необходимых мер предосторожности
ГДЗ — лучшее решение проблем
Химия пригодится ученикам как для получения многих профессий, так и для решения бытовых вопросов. Это изначально кажется, что знать непростые соединения и вещества в принципе не обязательно, ведь у ребят нет осознания того, зачем именно они все это учат. Таким образом могут возникнуть многочисленные пробелы, которые помешают правильно воспринимать последующий материал. Решебник к учебнику по химии за 9 класс Рудзитис Г.Е., Фельдман Ф.Г. (ФГОС) позволит быстро и качественно освоить предмет.
Используя справочник для систематических занятий, ученики получат возможность:
- улучшить качество домашних заданий;
- своевременно находить и устранять ошибки;
- тщательно разбирать непонятные темы;
- заранее готовиться к многочисленным проверочным испытаниям.
Работать с решебником подростки могут в удобном для себя темпе, так как издание доступно онлайн и открыть его легко с любого гаджета, подключенного к Интернету. Уделяя тренировкам хотя бы несколько минут в день, отстающие от программы учащиеся не только нагонят одноклассников, но и продвинутся вперед, что обеспечит им хорошие оценки и похвалу учителя.
Ответы на задания по химии за девятый класс к учебнику Рудзитис Г.Е., Фельдман Ф.Г.
Глава I
Лабораторные опыты:
задание-1задание-2задание-3задание-4
Практические работы:
задача-1задача-2задача-3задача-4задача-5задача-6
§§1-3 :
вопрос-1задача-1задача-2вопрос-2вопрос-3вопрос-4вопрос-5вопрос-6вопрос-7вопрос-8вопрос-9вопрос-10
§§4-6 :
вопрос-1задача-1вопрос-2задача-2вопрос-3задача-3вопрос-4вопрос-5вопрос-6вопрос-7вопрос-8вопрос-9вопрос-10
Глава VII
Лабораторные опыты:
Практические работы:
§ 43-44:
Вопрос 1Задача 1Вопрос 2Задача 2Вопрос 3Задача 3Задача 4Вопрос 4Вопрос 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10
Глава II
Лабораторные работы:
Практические работы:
Задача 1Задача 2Задача 3Задача 4Задача 5Задача 6
§13:
Задача 1Вопрос 1Вопрос 2Задача 2Вопрос 3Вопрос 4
§14:
Вопрос 1Вопрос 2Вопрос 3Вопрос 4Вопрос 5
§§7-10:
Задача 1Вопрос 1Вопрос 2Задача 2Вопрос 3Вопрос 4Вопрос 5Вопрос 6
§11-12:
Вопрос 1Задача 1Задача 2Вопрос 2Вопрос 3Вопрос 4Вопрос 5
Глава VI
Лабораторная работа:
Практические работы:
§ 39:
Вопрос 1Задача 1Вопрос 2Задача 2Вопрос 3Задача 3Задача 4Вопрос 4Вопрос 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10Вопрос 11
§ 42:
Вопрос 1Задача 1Вопрос 2Задача 2Задача 3Вопрос 3Вопрос 4Вопрос 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10Вопрос 11
§ 40-41:
Вопрос 1Задача 1Вопрос 2Задача 2Вопрос 3Задача 3Задача 4Вопрос 4Вопрос 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10Вопрос 11Вопрос 12Вопрос 13Вопрос 14Вопрос 15
Глава V
Лабораторные опыты:
§ 34-38:
Вопрос 1Задача 1Задача 2Вопрос 2Задача 3Вопрос 3Вопрос 4Задача 4Вопрос 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10Вопрос 11Вопрос 12Вопрос 13Вопрос 14Вопрос 15
Глава III
Лабораторные работы:
Практические работы:
§15-18:
Задача 1Вопрос 1Вопрос 2Задача 2Вопрос 3Вопрос 4Вопрос 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10Вопрос 11Вопрос 12Вопрос 13Вопрос 14
§19-20:
задача 1вопрос 1задача 2вопрос 2вопрос 3задача 3вопрос 4вопрос 5вопрос 6вопрос 7вопрос 8вопрос 9
§21-23:
задача 1вопрос 1задача 2вопрос 2вопрос 3задача 3задача 4вопрос 4вопрос 5вопрос 6вопрос 7вопрос 8вопрос 9вопрос 10вопрос 11
Глава VIII
§ 45-47:
задача 1вопрос 1задача 2вопрос 2задача 3вопрос 3задача 4вопрос 4вопрос 5задача 5вопрос 6задача 6вопрос 7вопрос 8вопрос 9вопрос 10вопрос 11вопрос 12вопрос 13вопрос 14
Глава IV
Лабораторные работы:
§ 24-29:
задача 1вопрос 1задача 2вопрос 2задача 3вопрос 3вопрос 4задача 4задача 5вопрос 5вопрос 6вопрос 7вопрос 8вопрос 9вопрос 10вопрос 11вопрос 12вопрос 13вопрос 14вопрос 15вопрос 16вопрос 17вопрос 18вопрос 19вопрос 20вопрос 21вопрос 22вопрос 23
§ 30-33:
задача 1вопрос 1задача 2вопрос 2вопрос 3вопрос 4вопрос 5вопрос 6вопрос 7вопрос 8вопрос 9
Глава IX
Лабораторные опыты:
§ 48-54:
Задача 1Вопрос 1Вопрос 2Задача 2Вопрос 3Задача 3Вопрос 4Вопрос 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10Вопрос 11Вопрос 12Вопрос 13Вопрос 14Вопрос 15Вопрос 16Вопрос 17
§ 55-59:
Задача 1Вопрос 1Задача 2Вопрос 2Вопрос 3Задача 3Задача 4Вопрос 4Вопрос 5Задача 5Вопрос 6Вопрос 7Вопрос 8Вопрос 9Вопрос 10Вопрос 11Вопрос 12Вопрос 13Вопрос 14Вопрос 15






























