Как составить уравнение реакции
Одно из самых распространенных заданий на экзаменах и в контрольных работах – составить уравнение на реакцию HCl, в данном случае – соляной, с другими веществами или соединениями.

Чтобы не запутаться в решении, предлагаем несколько советов и шпаргалок для легкого запоминания:
- Запомните буквенное обозначение данного вещества – соляная кислота в химии обозначается как HCl: если вещество разбавленное, это указывается в скобках рядом.
- Как уже было сказано выше, вещество способно реагировать с активными металлами, стоящими до водорода в электрохимическом ряду; кроме того, она реагирует на основания, оксиды, гидроксиды и карбонаты.
- Химические основания обозначаются как OH, оксиды – O, гидроксиды – OH2, карбонаты – CO3.
- Уравнение реакции всегда будет иметь знак +, потому как в процессе взаимодействия происходит соединение нескольких компонентов.
- HCl может идти первым или вторым слагаемым, после прибавления металла, вещества идет знак =, после этого описывается реакция, где указаны продукты распада.
- Например, при реакции кислоты серы с сульфатом магния получается такое уравнение: Mg+H2SO4 = MgSO4+H2.
- Соляная кислота и гидроксид бария дают такое уравнение: 2HCl + Ba(OH)2 = BaCl2 + 2H2O.
- При реакции соединения водорода, хлора и мела образуется хлорид кальция: СаСО3 + 2HCl = CaCl2 + СО2 + Н2О.
- Раствор карбоната натрия с кислотой выглядит так: HCl+Na2CO3=2NaCl+H2O+CO2.
Составить уравнение несложно, важно изначально правильно обозначить буквенные символы каждого элемента или вещества. Для правильного уравновешивания формулы пользуются правилами школьного курса химии, основанными на математическом принципе расстановки коэффициентов
Для правильного уравновешивания формулы пользуются правилами школьного курса химии, основанными на математическом принципе расстановки коэффициентов.
🎦 Видео
Практическая работа 5. Получение водорода и изучение его свойствСкачать

Лабораторная работа №10. Изучение свойств раствора хлороводородной кислоты. 9 класс.Скачать

Получение СОЛЯНОЙ кислотыСкачать

Получение соляной кислотыСкачать

Получение соляной кислотыСкачать

Химические свойства соляной кислотыСкачать

Лабораторная работа «Изучение свойств соляной кислоты»Скачать

Практическая работа №5. Получение углекислого газа, качественная реакция на карбонат ионыСкачать

Химия-9. Практическая работа 2. Изучение свойств соляной кислоты.Скачать

Практическая работа №5. Получение, собирание и распознавание водорода.Скачать

Получение соляной кислотыСкачать

Получение хлороводородаСкачать
Практическая работа №4 Получение аммиака и изучение его свойствСкачать

Практическая работа » Получение кислорода и изучение его свойств»/ химия8Скачать

Хлороводородная кислота. 9 класс.Скачать

Химия 9 класс (Урок№10 — Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

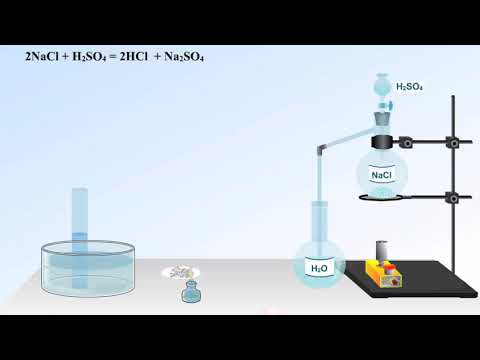
Получение соляной кислоты (НСl)
а) Будучи нелетучей сильной кислотой, H2SO4 способная вытеснять другие кислоты из их солей. В данном случае НСl также сильная кислота, но она обладает летучими свойствами. Поэтому для ее получения используют реакцию при нагревании.
В сильно кислой среде средняя соль Na2SO4 переходит в кислую NaHSO4.
Na2SO4 + H2SO4 2NaHSO4.
Без нагревания в растворе устанавливается ионное равновесие. Хлороводород не выделяется.
NaCl + H2SO4 NaHSO4 + HCl.
Видео:Получение соляной кислоты и его свостваСкачать

2) Раствор хдороводорода немного тяжелее воды, поэтому мы можем наблюдать тонкие опускающиеся струйки еще не перемешавшейся, только что образовавшейся при растворении соляной кислоты. 3) Хдороводород очень хорошо растворим в воде. Если конец газоотводной трубки опустить низко к поверхности воды, то может произойти всасывание раствора в трубку. Посмотрите рис. 18 из учебника (стр. 83), иллюстрирующий хорошую растворимость хлороводорода в воде.
Изучение свойств соляной кислоты
Для изучения свойств соляной кислоты проведем несколько характерных для нее реакций. 1) Не все металлы реагируют с соляной кислотой. Идет реакция, или нет зависит от активности металла. Чем активней металл, тем быстрее идет взаимодействие. Для удобства можно рассмотреть электрохимический ряд напряжений металлов (он находится на форзаце в конце учебника). Тогда металлы, находящиеся перед Н2, реагируют с кислотами, после Н2 — не реагируют. Поэтому Zn и Mg вытесняют Н2 из кислоты:
С медью соляная кислота не реагирует.
2) В четвертой пробирке протекает реакция:
СuO растворяется в кислоте, образуется голубой раствор за счет окрашенных ионов Сu2+. В пятой пробирке происходит растворение Сu(OH)2 в НСl.
Видео:Получение соляной кислотыСкачать

Сu(OH)2 + 2HCl CuCl2 + 2H2O.
Также образуется голубой раствор (Сu2+). В шестой пробирке:
Более сильная кислота вытесняет более слабую угольную кислоту, которая разлагается на углекислый газ и воду:
3) Сначала запишем все реакции с АgNO3.
Видео:Практическая работа №2 Изучение свойств соляной кислотыСкачать

HCl + AgNO3 AgCl↓ + HNO3; NaCl + AgNO3 AgCl↓ + NaNO3; CaCl2 + 2AgNO3 2AgCl↓ + Ca(NO3)2.
Во всех пробирках выпадает белый осадок, не растворимый в концентрированной азотной кислоты. Аналогично происходят реакции с нитратом свинца (II).
2HCl + Pb(NO3)2 PbCl2↓ + 2HNO3; 2NaCl + Pb(NO3)2 PbCl2↓ + 2NaNO3; CaCl2 + Pb(NO3)2 PbCl2↓ + Ca(NO3)2.
Признак взаимодействия с цинком, железом и другими металлами
Если курс школьной химии был успешно забыт, можно вспомнить о том, какие бывают признаки взаимодействия металлов, вступающих в реакцию с соляной кислотой.
Чтобы экспериментальные опыты не вызвали несчастного случая, рекомендуется заранее открыть все окна, вооружиться защитной одеждой, чтобы кожа рук была закрыта.
Также рекомендуется использовать перчатки и повязку на лицо.
Обратите внимание! Ниже будет рассказано о том, какие признаки говорят о вступлении в реакцию элементов с соединением. Чтобы не проводить наглядные опыты, можно воспользоваться теоретической информацией
Чтобы не проводить наглядные опыты, можно воспользоваться теоретической информацией.

Рассмотрим, что происходит, если добавить немного кислоты на определенный вид металла:
| Металл | Признак взаимодействия |
| Цинк | Если опустить этот металл серебристого цвета в пробирку с указанным веществом, можно постепенно наблюдать выделение небольшого количества пузырьков и водорода. |
В результате возникает хлорид цинка ZnCl₂
Железо
Во время такого взаимодействия образуется хлористое железо.
Реакция происходит медленно, однако, если пробирку подогреть, то процесс пойдет быстрее
Литий
При реакции образуется хлорид лития 2LiCl, выделяется водород.
На поверхности этого металла, относящегося к щелочной группе, можно увидеть маленькие пузыри
Кремний
В результате такого соединения возникает сложный компонент под названием хлорсилан.
Также выделяется газообразный водород. Такая реакция происходит при условии нагревания до 350 градусов, а в качестве катализатора выступает медь
Магний
При таком взаимодействии наблюдает выделение теплоты, металл начинает плавиться
Лабораторный опыт №17. Взаимодействие железа с соляной кислотой.
В пробирку налейте 2-3 мл соляной кислоты и поместите в неё канцелярскую скрепку или 2-3 скобки для степлера. Что наблюдаете? Докажите, что в результате реакции образуются хлорид железа (II) и водород. Запишите уравнение реакции и рассмотрите окислительно-восстановительные процессы.
При добавлении соляной кислоты к канцелярской скрепке, наблюдается выделение газа, и окрашивание раствора в зеленый цвет:
| Fe + 2HCl ⟶ FeCl2 + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Fe 0 — 2ē ⟶ Fe +2 | 1 | восстановитель (окисление) |
Доказать наличие водорода можно с помощью нагретой медной проволоки покрытой черным оксидом меди (II), если в результате реакции выделяется водород, то черный цвет проволоки сменится на золотисто-розовый, т. к. оксид меди (II) восстановится до меди:
| CuO + H2 t ⟶ Cu + H2O | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Fe 0 — 2ē ⟶ Fe +2 | 1 | восстановитель (окисление) |
Доказать наличие двухвалентного железа можно с помощью красной кровяной соли, в результате реакции выпадает осадок гексацианоферрата (III) калия-железа (II) темно-синего цвета:FeCl2 + K3[Fe(CN)6] ⟶ KFe[Fe(CN)6]↓ + 2KCl
Какие вещества вступают в реакцию с соляной кислотой
На вступительных экзаменах по химии часто можно встретить задание на определение веществ, которые способны реагировать на соляную кислоту.
Кроме того, задание «составьте уравнение» нередко вызывает страх в глазах выпускников.
Чтобы не путаться с химическими задачами, рекомендуется подробнее изучить информацию о взаимодействии с данным соединением.
Все существующие вещества можно поделить на металлы, вытесняющие водород из соединения, не вытесняющие водород, а также активные и неактивные металлы.
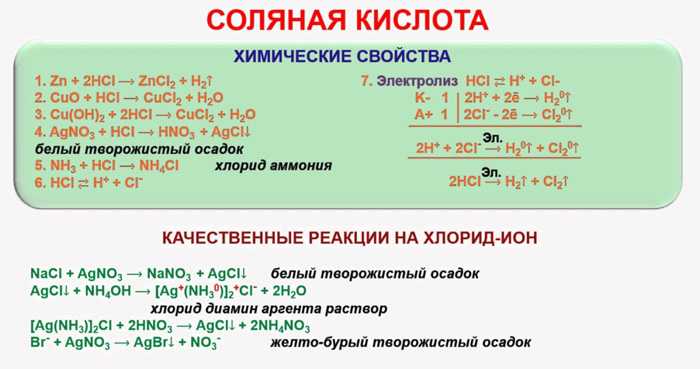
В реакцию с соляной кислотой вступают такие вещества:
- Химические основания. Соляная кислота способна нейтрализовать основания. Как известно, они состоят из атома металла, на который и воздействует кислота.
К ним относят гидроксид натрия, бария, алюминия. Реакция нейтрализации дает образования соли и воды.Металлы. Если обратиться к электрохимическому ряду, можно увидеть, что соляная кислота реагирует со всеми элементами, стоящими до водорода в этом ряду.
Сюда относят натрий, магний, алюминий, литий, барий, кальций, цинк, железо и другие элементы. При взаимодействии они образуют хлориды и выделяют газообразный водород.
Основные и атмосферные оксиды. Во время реакции происходит образование растворимых солей и воды. HCl взаимодействует с оксидом алюминия, меди, цинка, натрия.
Карбонаты. При взаимодействии с карбонатами кальция получится следующее уравнение: CaCO₃ + 2HCl→ CaCl₂ + CO₂↑ + H₂O.
Из него следует, что выделяется углекислый газ, а также образуется вода и угольная кислота.
Сильные окислители. Если вещество взаимодействует с перманганатом калия или диоксидом марганца, на выходе получается выделение газообразного хлора.
Аммиак. Такое взаимодействие ознаменовано выделением сильного дыма, поэтому в момент проведения опытов рекомендуется открыть все окна. Тогда выделяется хлорид аммония.






























